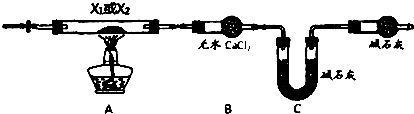
题目内容
11.关于CO2的叙述中,正确的是( )| A. | CO2的摩尔质量是44g | |
| B. | 1molCO2中所含分子数约为6.02×1023 | |
| C. | 1molCO2的质量是44g/mol | |
| D. | 常温常压下,1molCO2的体积为22.4L |
分析 A、摩尔质量的单位是g/mol;
B、1mol任何物质中所含分子数约为6.02×1023;
C、质量的单位是g;
D、标准状况下,气体摩尔体积为22.4L/mol.
解答 解:A、摩尔质量的单位是g/mol,所以CO2的摩尔质量是44g/mol,故A错误;
B、1mol任何物质中所含分子数约为6.02×1023,所以1molCO2中所含分子数约为6.02×1023,故B正确;
C、质量的单位是g,所以1molCO2的质量是44g,故C错误;
D、标准状况下,气体摩尔体积为22.4L/mol,所以标准状况下,1molCO2的体积约为22.4L,故D错误;
故选B.
点评 本题考查了质量、摩尔质量的单位及物质的量和体积、粒子数的换算,理解概念、熟记基本公式并灵活运用是解本题关键.注意质量和摩尔质量单位的不同,为易错点.

练习册系列答案
相关题目
2.下列化学用语书写正确的是( )
| A. | 氯离子的结构示意图: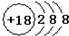 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: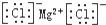 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
19.下列溶液:①澄清石灰水;②酸性高锰酸钾溶液;③氯化钡溶液;④品红溶液.能用来区别SO2和CO2气体的是( )
| A. | ①③ | B. | ②③ | C. | ①② | D. | ②④ |
6.可逆反应mA(s)+n D(g)?pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T 或压强P关系如图所示(D%为D的转化率),下列叙述中正确的是( )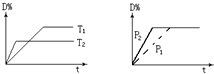

| A. | 正反应为放热反应 | |
| B. | 使用催化剂,D的物质的量减小 | |
| C. | 化学方程式系数m+n=p+q | |
| D. | 增加物质A或D的用量,平衡均向右移动 |
16.下列溶液呈中性的是( )
| A. | 将水加热使KW增大、pH<7 | |
| B. | 由水电离的c(H+)=10-10 mol•L-1的溶液 | |
| C. | 加水稀释除H+浓度增大外其它粒子浓度降低的溶液 | |
| D. | 非电解质溶于水得到的溶液 |
3.下列离子方程式书写正确的是( )
| A. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
20.氢化钙(CaH2)可作为生氢剂,反应的化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,下列说法不正确的是( )
| A. | CaH2既是还原剂,又是氧化剂 | B. | H2既是氧化产物,又是还原产物 | ||
| C. | CaH2是还原剂,H2O 是氧化剂 | D. | 氧化产物与还原产物质量比为1:1 |
1.将煤粉隔绝空气加强热,除主要得到焦炭外,还能得到如表所列的物质:
(1)表中所列物质不属于有机物的是(填序号):②⑥.
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)彼此互为同系物的是(填序号):④⑤.
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:nCH2=CH2$\stackrel{引发剂}{→}$ .
.
(5)甲苯的一氯取代产物有4种.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)彼此互为同系物的是(填序号):④⑤.
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:nCH2=CH2$\stackrel{引发剂}{→}$
 .
.(5)甲苯的一氯取代产物有4种.