题目内容
3.下列离子方程式书写正确的是( )| A. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
分析 A.反应生成氢氧化铝和氯化铵;
B.反应生成碳酸氢钙和HClO;
C.电子、电荷不守恒;
D.反应生成硫酸钡和氢氧化铜.
解答 解:A.AlCl3溶液与过量的浓氨水反应的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向Ca(ClO)2溶液通入过量的CO2的离子反应为ClO-+CO2+H2O═HCO3-+HClO,故B错误;
C.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故C错误;
D.CuSO4溶液与少量的Ba(OH)2溶液的离子反应为Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.已知丙烷的二氯代物C3H6Cl2有4种同分异构体,则分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
11.关于CO2的叙述中,正确的是( )
| A. | CO2的摩尔质量是44g | |
| B. | 1molCO2中所含分子数约为6.02×1023 | |
| C. | 1molCO2的质量是44g/mol | |
| D. | 常温常压下,1molCO2的体积为22.4L |
18.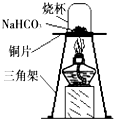 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体.
【进行实验】为了验证碳酸氢钠受热时的分解产物,兴趣小组的同
学取一定质量的碳酸氢钠放到铜片上充分加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有无色小液滴,证明生成了水.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,
振荡,观察有关现象,说明生成了二氧化碳.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是质量守恒定律(或化学反应前后元素种类不变、化学反应前后原子种类不变、NaHCO3中含有Na、H、C、O元素等,合理答案均可).
②兴趣小组为确定反应后的固体产物成分进行了以下实验,请填写下表:
【讨论与评价】实验一的结论与实验二、实验三的结论相反,兴趣小组的同学认为方案一的结论不正确,他们的理由是碳酸钠溶液呈碱性,也能使溶液变成红色.
【拓展应用】碳酸氢钠常用来治疗胃酸过多,但对于患胃溃疡的病人胃酸(用盐酸表示)过多时,却不宜服用碳酸氢钠,用化学方程式表示其原因是HCl+NaHCO3=NaCl+CO2↑+H2O.
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体.
【进行实验】为了验证碳酸氢钠受热时的分解产物,兴趣小组的同
学取一定质量的碳酸氢钠放到铜片上充分加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有无色小液滴,证明生成了水.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,
振荡,观察有关现象,说明生成了二氧化碳.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是质量守恒定律(或化学反应前后元素种类不变、化学反应前后原子种类不变、NaHCO3中含有Na、H、C、O元素等,合理答案均可).
②兴趣小组为确定反应后的固体产物成分进行了以下实验,请填写下表:
| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
【拓展应用】碳酸氢钠常用来治疗胃酸过多,但对于患胃溃疡的病人胃酸(用盐酸表示)过多时,却不宜服用碳酸氢钠,用化学方程式表示其原因是HCl+NaHCO3=NaCl+CO2↑+H2O.
8.下列说法中正确的是( )
| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 高温结构陶瓷材料Si3N4固体是分子晶体 | |
| C. | 分子晶体在水溶液中一定导电 | |
| D. | NaCl和HCl溶于水时,均破坏都是离子键 |
15.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
 HClO+OH-.
HClO+OH-.