题目内容
2.下列化学用语书写正确的是( )| A. | 氯离子的结构示意图: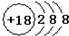 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: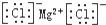 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
分析 A.氯离子的核电荷数为17;
B.氯化氢分子中不存在氢氯键,中心原子为O原子;
C.氯化镁属于离子化合物,其电子式需要标出所带电荷,氯离子还需要标出最外层电子;
D.氯化氢为共价化合物,分子中不存在阴阳离子.
解答 解:A.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为: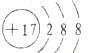 ,故A错误;
,故A错误;
B.次氯酸分子中含有1个氧氢键和1个氧氯键,次氯酸正确的结构式为:H-O-Cl,故B错误;
C.氯化镁为离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化镁正确的电子式为: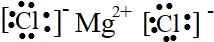 ,故C正确;
,故C正确;
D.氯化氢属于共价化合物,氯化氢的电子式中不能标出电荷,用电子式表示氯化氢的形成过程为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了电子式、离子结构示意图、电子式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确离子化合物与共价化合物电子式的区别,为易错点.

练习册系列答案
相关题目
12.下列离子方程式中,书写正确的是( )
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | Na与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
17.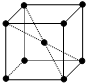 金属钠晶体为体心立方晶体(晶胞如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
金属钠晶体为体心立方晶体(晶胞如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
 金属钠晶体为体心立方晶体(晶胞如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
金属钠晶体为体心立方晶体(晶胞如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )| A. | 3$\sqrt{\frac{2a}{{N}_{Aρ}}}$ | B. | $\sqrt{3}$×3$\sqrt{\frac{2a}{{N}_{Aρ}}}$ | C. | $\frac{\sqrt{3}}{4}$×3$\sqrt{\frac{2a}{{N}_{Aρ}}}$ | D. | $\frac{1}{2}$×3$\sqrt{\frac{2a}{{N}_{Aρ}}}$ |
7.工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知在25.C时:
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
则反应CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=-241kJ•mol-1(3分)
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①以下反应能说明CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡状态的是a
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C.ν(CO)正=ν(H2O )正 D.容器中混合气体的平均相对分子质量保持不变
②实验Ⅰ中,从反应开始到反应达到平衡时,CO的平均反应速率ν(CO)=0.16mol/(L.min);;
③实验Ⅱ条件下反应的平衡常数K=0.33(保留小数点后二位).若降低温度,化学平衡常数K将增大(填“增大”“减小”或“不变”).
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时ν(正)>ν(逆)(填“>”或“<”),平衡向正反应方向移动(填“正反应”“逆反应”“不移动”)
(1)已知在25.C时:
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ•mol-1
C(石墨,s)+O2(g)═CO2(g)△H2=-494kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-142kJ•mol-1
则反应CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=-241kJ•mol-1(3分)
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 超始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| 3 | 900 | a | b | c | d | t |
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C.ν(CO)正=ν(H2O )正 D.容器中混合气体的平均相对分子质量保持不变
②实验Ⅰ中,从反应开始到反应达到平衡时,CO的平均反应速率ν(CO)=0.16mol/(L.min);;
③实验Ⅱ条件下反应的平衡常数K=0.33(保留小数点后二位).若降低温度,化学平衡常数K将增大(填“增大”“减小”或“不变”).
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时ν(正)>ν(逆)(填“>”或“<”),平衡向正反应方向移动(填“正反应”“逆反应”“不移动”)
14.已知丙烷的二氯代物C3H6Cl2有4种同分异构体,则分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
11.关于CO2的叙述中,正确的是( )
| A. | CO2的摩尔质量是44g | |
| B. | 1molCO2中所含分子数约为6.02×1023 | |
| C. | 1molCO2的质量是44g/mol | |
| D. | 常温常压下,1molCO2的体积为22.4L |
 HClO+OH-.
HClO+OH-.