题目内容
3.分类是学习和研究化学的一种重要方法,下列分类不合理的是( )| A. | K2CO3和CaSO4都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Fe(OH)3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
分析 电离时生成的阳离子全部是氢离子的化合物叫酸;
电离时生成的阴离子全部是氢氧根离子的化合物叫碱;
电离时生成金属离子和酸根离子的化合物叫盐;
由两种元素组成其中一种是氧元素的化合物叫氧化物;
据定义分析即可.
解答 解:A、K2CO3属于盐,CaSO4属于盐,故A正确;
B、H2SO4和HNO3都属于酸,故B正确;
C、KOH属于碱,Fe(OH)3属于碱,故C正确.
D、Na2O属于氧化物,Na2SiO3属于盐,故D错误.
故选D.
点评 本题考查了酸、碱、盐、氧化物的概念,难度不大,注意这几个概念的区别,题目较简单.

练习册系列答案
相关题目
14.以下有关原子结构及元素周期律的叙述中正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 同主族元素的简单阴离子还原性越强,水解程度越大 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
18.硫酸的消耗量是衡量一个国家化学工业发展水平的重要标志,H2SO4的相对分子质量为( )
| A. | 34 | B. | 98 | C. | 114 | D. | 128 |
8.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙烷和苯 | C. | 乙烯和乙炔 | D. | 甲烷和丙烷 |
15.我国酸雨形成的主要原因是( )
| A. | 汽车排出的大量尾气 | B. | 自然界中硫化物的分解 | ||
| C. | 工业上大量燃烧含硫的燃料 | D. | 制硝酸厂排出的大量尾气 |
12.下列金属元素中,不属于碱金属元素的是( )
| A. | Li | B. | Na | C. | Rb | D. | Mg |
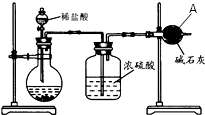 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)