题目内容
2.已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则WgR原子完全转化为R2-时,含有电子的物质的量是( )| A. | $\frac{m-x-2}{W-m}$ mol | B. | $\frac{W(m-x)}{m}$ mol | C. | $\frac{W(m-x-2)}{m}$mol | D. | $\frac{W(m-x+2)}{m}$ mol |
分析 由Rn-阴离子的原子核内有x个中子,R原子的质量数为m,则R原子质子数为m-x,故该离子核外电子数为m-x+2,根据n=$\frac{m}{M}$计算W g R2-的物质的量,进而计算含有电子物质的量.
解答 解:由Rn-阴离子的原子核内有x个中子,R原子的质量数为m,则R原子质子数为m-x,故该离子核外电子数为m-x+2,W g R2-的物质的量为$\frac{Wg}{mg/mol}$=$\frac{W}{m}$mol,故含有电子物质的量(m-x+2)×$\frac{W}{m}$mol,故选D.
点评 本题考查原子构成微粒之间的关系、常用化学计量的有关计算等,难度不大,注意质量数近似等于相对原子质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.己烯雌酚是一种激素类药物,结构如下:
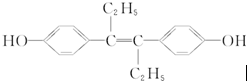
,下列有关叙述中不正确的是( )

,下列有关叙述中不正确的是( )
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
10. 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
7.为把溴水中溴单质萃取出来,下列物质可达到目的是( )
| A. | 乙醇 | B. | 苯酚溶液 | C. | 直馏汽油 | D. | 乙酸 |
14.以下有关原子结构及元素周期律的叙述中正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 同主族元素的简单阴离子还原性越强,水解程度越大 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
12.下列金属元素中,不属于碱金属元素的是( )
| A. | Li | B. | Na | C. | Rb | D. | Mg |
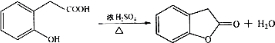
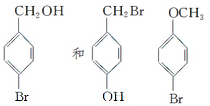
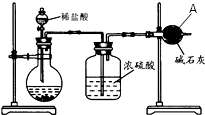 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)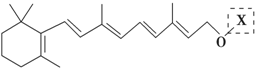 在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(
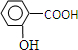
在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(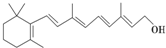 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. .
. .
. .
.