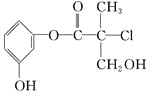
题目内容
【题目】如图所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10 mL盐酸于试管中,试回答下列问题:
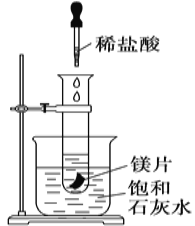
(1)实验中观察到的现象是________________________________ 。
(2)产生上述现象的原因是____________________________。
(3)写出有关反应的离子方程式:_________________________________; 反应中转移了0. 04mol电子时;标准状况下产生多少________mL的H2。
(4)由实验推知,镁片溶液和盐酸的总能量________(填“大于”、“小于”或“等于”) MgCl2和H2的总能量;此反应为________ (填放热反应或者吸热反应)。
【答案】镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 448 大于 放热反应
【解析】
如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使溶液看上去变浑浊;碳酸在溶液中不稳定分解生成二氧化碳气体。
(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊;
故答案为:镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊;
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状;
故答案为:镁与盐酸反应产生H2,该反应为放热反应,Ca(OH)2在水中溶解度随温度升高而减小,故析出Ca(OH)2晶体;
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为![]() ,离子方程式为:
,离子方程式为:![]() ;此反应中,当生成1mol氢气时转移2mol电子,故当转移0.04mol电子时,生成0.02mol电子,在标况下体积为448mL;
;此反应中,当生成1mol氢气时转移2mol电子,故当转移0.04mol电子时,生成0.02mol电子,在标况下体积为448mL;
故答案为:Mg+2H+=Mg2++H2↑;448;
(4)此反应是放热反应,故镁片的盐酸的总能量大于MgCl2溶液和H2的总能量;
故答案为:大于;放热反应。

 应用题作业本系列答案
应用题作业本系列答案【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A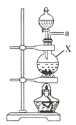 B
B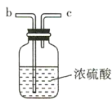
C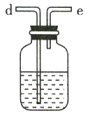 D
D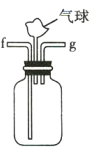
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
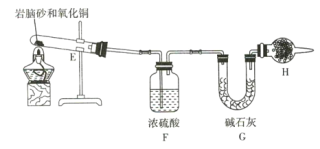
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。