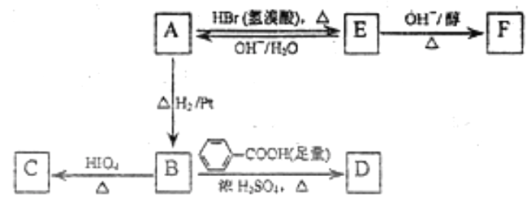
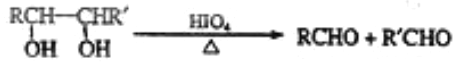题目内容
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
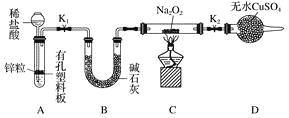
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
【答案】反应生成了碱(NaOH) 反应生成的H2O2具有漂白作用 2H2O2![]() 2H2O+O2↑ 长颈漏斗 吸收氢气中的杂质气体(水蒸气、氯化氢等) 防止空气与氢气混合加热爆炸 检验有无水生成 Na2O2+H2
2H2O+O2↑ 长颈漏斗 吸收氢气中的杂质气体(水蒸气、氯化氢等) 防止空气与氢气混合加热爆炸 检验有无水生成 Na2O2+H2![]() 2NaOH
2NaOH
【解析】
(1)①Na2O2与水反应生成氢氧化钠,使酚酞溶液变红;红色褪去的可能原因是过氧化钠和水反应生成的过氧化氢具有氧化性,能氧化有色物质;
②过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)①分析装置图和实验步骤可知,盛盐酸的仪器为长颈漏斗;B装置是吸收氢气中的杂质气体,除去氢气中的水蒸气等;
②氢气是可燃性气体混有空气易点燃发生爆炸,验纯防止空气与氢气混合加热爆炸;
③D装置是防止空气中的二氧化碳和水蒸气进入C影响实验验证;
④实验现象分析可知过氧化钠变为白色固体,硫酸铜不变蓝色证明无水生成,证明氢气和过氧化钠反应生成氢氧化钠,反应的化学方程式为Na2O2+H2![]() 2NaOH。
2NaOH。

 精英口算卡系列答案
精英口算卡系列答案