题目内容
1.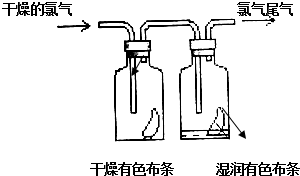 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.(2)为防止氯气尾气污染空气,实验室通常用NaOH溶液吸收多余的氯气,原理是(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是C(用字母代号填).
A.O2B.Cl2C.CO2D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散.当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是D(用字母代号填).
A.NaOH B.NaCl C.KCl D.Na2CO3.
分析 (1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;
(2)利用氯气和氢氧化钠溶液反应来处理尾气;石灰乳吸收工业氯气尾气制得漂白粉生成氯化钙、次氯酸钙,长期露置于空气中的漂白粉,变质生成碳酸钙,加稀盐酸后产生的气体为二氧化碳;
(3)强碱具有腐蚀性,利用弱碱性溶液吸收氯气.
解答 解:(1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;Cl2+H2O=HCl+HClO;干燥的有色布条无明显现象,潮湿的有色布条褪色,
故答案为:干燥的有色布条无明显现象,潮湿的有色布条褪色;
(2)为了防止氯气尾气污染空气,可用NaOH溶液吸收,该反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,漂白粉的有效成分是次Ca(ClO)2;长期露置于空气中的漂白粉,会和空气中的二氧化碳水反应生成碳酸钙和次氯酸,次氯酸分解,最后主要含碳酸钙,加稀盐酸后产生的气体是二氧化碳,
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O;Ca(ClO)2;C;
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,水溶液能较易吸收氯气,但不能对人有腐蚀作用;
A.NaOH是强碱具有强腐蚀性,故不选;
B.NaCl不能吸收氯气,故不选;
C.KCl不能吸收氯气,故不选;
D.Na2CO3溶液水解显碱性,可以吸收氯气,腐蚀性较小,符合要求,故选;
故答案为:D.
点评 本题考查氯气的性质及实验装置,为高频考点,把握氯气与水、碱的反应及尾气处理等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
3.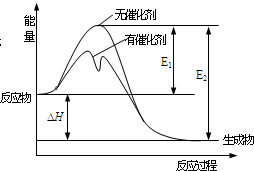 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | 升高温度,不影响活化分子百分数 | |
| C. | 使用催化剂使该反应的反应热发生改变 | |
| D. | E1-E2=△H |
12.下列说法正确的是( )
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c | |
| B. | 常温下5.0×10-3mol/LKHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(OH)2(s)?M2+(aq)+2OH-(aq)Ksp=a; 当含M(OH)2固体的悬浊液中 c(M2+)=b mol/L时,溶液的pH等于14+$\frac{1}{2}1g(\frac{b}{a})$ | |
| D. | 图中a点溶液中各离子浓度的关系是: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
9.下列离子方程式正确的是( )
| A. | AlCl3溶液中通入过量的氨水:Al3++4NH3•H2O=AlO2-+2H2O+4NH4+ | |
| B. | 向NH4HCO3 溶液中加过量NaOH 溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O |
16.下列说法正确的是( )
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 摩尔是物质的量的单位 | |
| C. | 阿伏加德罗常数就是6.02×1023 | |
| D. | CO2的摩尔质量为44g |
6.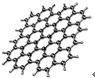 从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )
从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )
 从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )
从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示.下列关于石墨烯的说法正确的是( )| A. | 具有良好的导电性 | B. | 属于高分子化合物 | ||
| C. | 与金刚石互为同位素 | D. | 不能与氧气发生反应 |
13.下列物质分别与水溶液中的Fe3+发生反应,并生成等量的Fe2+时,消耗还原剂的物质的量最少的是( )
| A. | Cu | B. | Fe | C. | SO2 | D. | I- |
10.硫酸的产量是衡量一个国家化工水平的标志.2SO2(g)+O2(g)═2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.
下列判断中,正确的是( )
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.4 | 0.8 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲中反应的平衡常数大于乙 | B. | 平衡时,SO2的转化率:α1<80%<α2 | ||
| C. | 该温度下,乙中平衡常数值为400 | D. | 平衡时,丙中c(SO3)是甲中的2倍 |
11.汽车排气管加装催化装置,可有效减少CO和NOx的排放.催化装置内发生的反应为:NOx+CO→N2+CO2,下列说法一定正确的是( )
| A. | 上述氧化物均为酸性氧化物 | |
| B. | 反应中既有极性键也有非极性键形成 | |
| C. | 当x=2时,转移的电子数为4×6.02×1023 | |
| D. | 该反应为置换反应 |