题目内容
【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2 , 其部分生产流程如下: 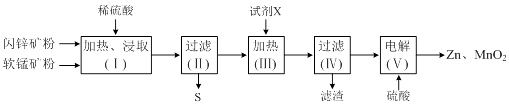
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 .
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: .
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . pH调节的范围是 , 试剂X可以选用(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3H2O
(4)电解(Ⅴ)中阳极的电极反应式为 .
(5)Zn和MnO2是制作电池的原料.某锌﹣锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为 .
【答案】
(1)加快反应(浸取)速率
(2)2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O
(3)5.2~6.4;AC
(4)Mn2++2H2O﹣2e﹣=MnO2+4H+
(5)2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣
【解析】解:(1)加热、浸取时所加矿石均需粉碎,其目的是:加快反应(浸取)速率,故答案:加快反应(浸取)速率;(2)FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O,
所以答案是:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O;(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . 结合图表数据分析,选择溶液PH能使铁离子、铝离子全部沉淀,锰离子不沉淀,图表中离子开始菜单和菜单完全的溶液PH得到,pH调节的范围是:5.2~6.4,加入试剂不能引入新的杂质,试剂X可以选择,
A.MnCO3 和酸反应且不引入新的杂质,故A正确;
B.Na2CO3 和酸反应但会引入新的杂质钠离子,故B错误;
C.Zn2(OH)2CO3 和酸反应,不引入新的杂质,故C正确;
D.NH3H2O和酸反应,但会引入新的杂质铵根离子,故D错误;
所以答案是:5.2~6.4;AC;(4)电解ZnSO4、MnSO4溶液,根据溶液中离子的放电顺序,阳极反应:Mn2+﹣2e﹣+2H2O═MnO2+4H+ , Fe作阴极,阴极反应:Zn2++2e﹣═Zn,
所以答案是:Mn2++2H2O﹣2e﹣=MnO2+4H+;(5)根据电极反应式Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),可知电池工作时,负极材料是Zn,发生氧化反应生成Zn(OH)2 , 电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2 , 正极材料为MnO2 , 发生还原反应,电极反应式为2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣ , 电子从负极沿导线流向正极,
所以答案是:2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣ .
