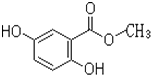
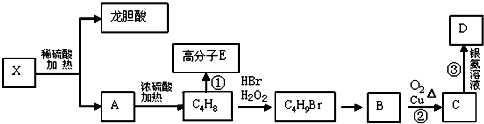
��Ŀ����
����Ŀ��þ��һ�ֻ��õĽ�����������CO2��ȼ������MgO��C����ˮ��þ�����ܴ�������������þ60%���Ժ�ˮ����ˮ��þ����Ҫ�ں�ˮ�мӼȻ����������ת��Ϊ�Ȼ�þ�������õ�����þ���Ը��������е�֪ʶ���ش��������⣺
��1����������ͼʽ��ʾ��ҵ���ú�ˮ����þ����Ҫ���� ��
��2��������þ����ȡ�������õ���Ȼ�þ�����еģ���д������Ȼ�þ�Ļ�ѧ����ʽ �� �ڵ������л�ԭ���� �� ���������� ��
��3�����õ���Ƶõ�þ����þ�ۣ��ɽ�þ���ȱ��������Ȼ����ȴ�õ�þ�ۣ�����������ڿ����н�����ԭ����ʲô�� �� �������壺������̼�����������������������������ѡ��������ȴþ�۵������� ��
���𰸡�
��1����ˮ ![]() ������þ
������þ ![]() �Ȼ�þ
�Ȼ�þ ![]() þ
þ
��2��MgCl2�����ڣ� ![]() Mg+Cl2����MgCl2��Cl2
Mg+Cl2����MgCl2��Cl2
��3�����ܣ�þ�ڿ����б����������������
���������⣺��1����ˮ����þ����Ҫ����������ͼʽ��ʾΪ����ˮ ![]() ������þ
������þ ![]() �Ȼ�þ
�Ȼ�þ ![]() þ�����Դ��ǣ���ˮ
þ�����Դ��ǣ���ˮ ![]() ������þ
������þ ![]() �Ȼ�þ
�Ȼ�þ ![]() þ����2���Ȼ�þ������ɵ���þ����������ѧ����ʽΪ��MgCl2�����ڣ�
þ����2���Ȼ�þ������ɵ���þ����������ѧ����ʽΪ��MgCl2�����ڣ� ![]() Mg+Cl2�����Ȼ�þ����������Ҳ�ǻ�ԭ�����������������������Դ��ǣ�MgCl2�����ڣ�
Mg+Cl2�����Ȼ�þ����������Ҳ�ǻ�ԭ�����������������������Դ��ǣ�MgCl2�����ڣ� ![]() Mg+Cl2����MgCl2��Cl2����3��þ��������Ӧ��������þ���͵�����Ӧ���ɵ���þ���������̼��Ӧ��������þ�͵���̼�����Բ����ڿ�������ȴþ��������þ���������������Ӧ��������ȴ�����Դ��ǣ����ܣ�þ�ڿ����б������������������
Mg+Cl2����MgCl2��Cl2����3��þ��������Ӧ��������þ���͵�����Ӧ���ɵ���þ���������̼��Ӧ��������þ�͵���̼�����Բ����ڿ�������ȴþ��������þ���������������Ӧ��������ȴ�����Դ��ǣ����ܣ�þ�ڿ����б������������������

 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�����Ŀ��ij�����������̿�MnO2������Al2O3������п��ZnS������FeS����������Zn��MnO2 �� �䲿�������������£� 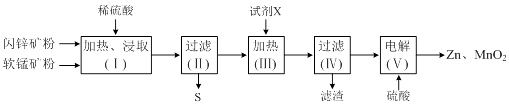
��֪�����ˣ���������Һ��MnSO4��ZnSO4��Fe2��SO4��3��Al2��SO4��3�Ļ��Һ����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩���±���
������ | Fe��OH��3 | Al��OH��3 | Zn��OH��2 | Mn��OH��2 |
��ʼ����ʱ��pH | 2.7 | 4.0 | 6.4 | 7.7 |
��ȫ����ʱ��pH | 3.7 | 5.2 | 8.0 | 10.4 |
��1�����ȡ���ȡʱ���ӿ�ʯ������飬��Ŀ���� ��
��2��д��FeS��MnO2��ϡ���ᷴӦ�����ӷ���ʽ�� ��
��3���Լ�X�������ǵ�����Һ��pH������Fe��OH��3��Al��OH��3 �� pH���ڵķ�Χ�� �� �Լ�X����ѡ������ѡ����ĸ����
A��MnCO3 B��Na2CO3 C��Zn2��OH��2CO3 D��NH3H2O
��4����⣨�����������ĵ缫��ӦʽΪ ��
��5��Zn��MnO2��������ص�ԭ�ϣ�ijп���̼��Ե����KOH��ҺΪ�������Һ�������ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+H2O��l��=Zn��OH��2��s��+Mn2O3��s�����õ�ص������ĵ缫��ӦʽΪ ��