题目内容
【题目】铜跟1mol/L的硝酸溶液反应,若C(NO3-)下降了0.2mol/L,则C(H+)下降
A. 0.2mol/L B. 0.8mol/L C. 0.6mol/L D. 0.4mol/L
【答案】B
【解析】由铜和稀硝酸反应的离子方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,参加 反应的硝酸根和氢离子的物质的量之比为2:8,所以当c(NO3-)下降了0.2mol/L,则c(H+)下降0.8mol/L,B正确 ,选B。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2 , 其部分生产流程如下: 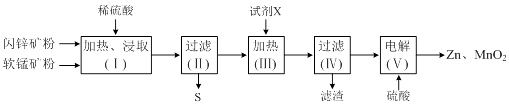
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 .
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: .
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . pH调节的范围是 , 试剂X可以选用(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3H2O
(4)电解(Ⅴ)中阳极的电极反应式为 .
(5)Zn和MnO2是制作电池的原料.某锌﹣锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为 .