题目内容
 研究铁及铁的化合物的性质具有重要意义.
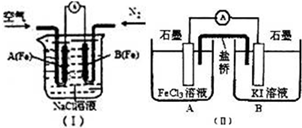
研究铁及铁的化合物的性质具有重要意义.(1)如图(I)是为研究钢铁腐蚀部位与水中O2浓度的关系而设计的装置,该装置化学上称为差异充气电池.实验中观察到电流计指针偏转,B(Fe)极被腐蚀,则A(Fe)极的电极反应式为
(2)常温下,铁可在某些强氧化剂溶液中形成钝化膜而被保护.为探究钝化膜的成分,取一小段钝化后的铁片放入稀硫酸中加热,使铁片完全溶解.取1mL溶解液滴入3~5滴KmnO4溶液,观察到溶液紫色逐渐退去,则该反应的离子方程式是
(3)FeC13溶液与KI溶液混合,离子方程式为
[方法1]取2mL0.1mol?L-1
[方法2]设计原电池装置如图(II),测得电流计指针偏转方向是电子的流动方向.开始观察到电流计指针向
分析:(1)根据钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子:2H2O+O2+4e-═4OH-,负极被腐蚀失电子变成离子进入溶液:Fe-2e-=Fe2;
(2)根据取一小段钝化后的铁片放入稀硫酸中加热,使铁片完全溶解,生成Fe2+,Fe2+具有还原性,能被酸性KMnO4溶液氧化;根据Fe3+遇KSCN溶液时溶液为血红色,而Fe2+遇KSCN溶液不变色;Fe能与Fe3+反应生成Fe2+;
(3)Fe3+具有氧化性,I-具有还原性,两者发生氧化还原反应;
[方法1]实验探究反应2Fe3++2I-=2Fe2++I2的可逆性,5mL 0.1mol?L-1KI溶液倒入试管,并滴加0.1mol?L-1FeCl3溶液5~6滴,KI过量,若反应为可逆反应,Fe3+遇KSCN溶液时溶液为血红色,淀粉遇单质碘溶液变蓝色以此来解答;
(5)根据2Fe3++2I-=2Fe2++I2结合原电池原理可知:A中的石墨棒为正极,B中的石墨棒为负极,电子的流动方向是从B流向A,计指针偏转方向是电子的流动方向;根据生成物的浓度增大,平衡逆向移动,电流计指针偏转方向相反.
(2)根据取一小段钝化后的铁片放入稀硫酸中加热,使铁片完全溶解,生成Fe2+,Fe2+具有还原性,能被酸性KMnO4溶液氧化;根据Fe3+遇KSCN溶液时溶液为血红色,而Fe2+遇KSCN溶液不变色;Fe能与Fe3+反应生成Fe2+;
(3)Fe3+具有氧化性,I-具有还原性,两者发生氧化还原反应;
[方法1]实验探究反应2Fe3++2I-=2Fe2++I2的可逆性,5mL 0.1mol?L-1KI溶液倒入试管,并滴加0.1mol?L-1FeCl3溶液5~6滴,KI过量,若反应为可逆反应,Fe3+遇KSCN溶液时溶液为血红色,淀粉遇单质碘溶液变蓝色以此来解答;
(5)根据2Fe3++2I-=2Fe2++I2结合原电池原理可知:A中的石墨棒为正极,B中的石墨棒为负极,电子的流动方向是从B流向A,计指针偏转方向是电子的流动方向;根据生成物的浓度增大,平衡逆向移动,电流计指针偏转方向相反.
解答:解:(1)图(I)是金属的吸氧腐蚀,B(Fe)极被腐蚀,则B(Fe)为负极,A(Fe)是正极,电极反应式为2H2O+O2+4e-═4OH-,(2)Fe2+→Fe3+,铁元素化合价升高1价;MnO4-+→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2++系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知缺项为H+,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为:5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O,Fe3+遇KSCN溶液时溶液为血红色,而Fe2+遇KSCN溶液不变色,发现溶液不变色,说明溶液中无Fe3+,但不能由此推断钝化膜中不含+3价的铁,因为Fe能与Fe3+反应生成Fe2+:Fe+2Fe3+=3Fe2+,
故答案为:2H2O+O2+4e-═4OH-;5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O;不能;Fe+2Fe3+=3Fe2+;
(3)Fe3+具有氧化性,I-具有还原性,两者发生氧化还原反应:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
[方法1]实验探究反应2Fe3++2I-=2Fe2++I2的可逆性,5mL 0.1mol?L-1KI溶液倒入试管,并滴加0.1mol?L-1FeCl3溶液5~6滴,KI过量,若反应为可逆反应,Fe3+遇KSCN溶液时溶液为血红色,淀粉遇单质碘溶液变蓝色,故答案为:KI;FeCl3;KSCN;淀粉;
[方法2]2Fe3++2I-=2Fe2++I2结合原电池原理可知:A中的石墨棒为正极,B中的石墨棒为负极,电子的流动方向是从B流向A,而计指针偏转方向是电子的流动方向,所以电流计指针向A;根据生成物的浓度增大,平衡逆向移动,电流计指针偏转方向相反,所以向A中加入FeCl2晶体,电流计指针偏向B,即证明电池反应达到平衡状态,故答案为:A;向A中加入FeCl2晶体,电流计指针偏向B.
故答案为:2H2O+O2+4e-═4OH-;5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O;不能;Fe+2Fe3+=3Fe2+;
(3)Fe3+具有氧化性,I-具有还原性,两者发生氧化还原反应:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
[方法1]实验探究反应2Fe3++2I-=2Fe2++I2的可逆性,5mL 0.1mol?L-1KI溶液倒入试管,并滴加0.1mol?L-1FeCl3溶液5~6滴,KI过量,若反应为可逆反应,Fe3+遇KSCN溶液时溶液为血红色,淀粉遇单质碘溶液变蓝色,故答案为:KI;FeCl3;KSCN;淀粉;
[方法2]2Fe3++2I-=2Fe2++I2结合原电池原理可知:A中的石墨棒为正极,B中的石墨棒为负极,电子的流动方向是从B流向A,而计指针偏转方向是电子的流动方向,所以电流计指针向A;根据生成物的浓度增大,平衡逆向移动,电流计指针偏转方向相反,所以向A中加入FeCl2晶体,电流计指针偏向B,即证明电池反应达到平衡状态,故答案为:A;向A中加入FeCl2晶体,电流计指针偏向B.
点评:本题主要考查了氧化还原反应、原电池原理、电极反应的运用,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 Cu(OH)2+2H+
Cu(OH)2+2H+

