题目内容
铁合金及铁的化合物在生产、生活中有着重要的用途.
(1)已知铁是26号元素,写出Fe2+的电子排布式 .
(2)已知三氯化铁固体在300℃以上可升华成含二聚三氯化铁(Fe2Cl6)分子的气体,该分子中所有原子均满足最外层8电子的稳定结构,则该分子的结构式为 ,你认为该分子是否为平面形分子? .
(3)六氰合亚铁酸钾K4[Fe(CN)6]俗称黄血盐,它可用做显影剂,该化合物中存在的化学键类型有 (从下列选项中选填:A.离子键 B.共价键 C.金属键 D.配位键 E.氢键).黄血盐在溶液中可电离出极少量的CN-,CN-与 互为等电子体(填一种即可).CN-还可与H+结合形成一种弱酸--氢氰酸(HCN),HCN分子中碳原子的杂化轨道类型是 ,该分子的键α和π键数目分别为 .
(4)黄血盐溶液与Fe3+反应可生成一种蓝色沉淀,该物质最早由1704年英国普鲁士的一家染料厂的工人发现,因此取名为普鲁士蓝,化学式可表示为KxFey(CN)z.研究表明它的晶体的结构特征是Fe2+、Fe3+分别占据立方体的顶点,且自身互不相邻,而CN-位于立方体的棱上与Fe2+、Fe3+配位,K+填充在上述微粒形成的部分空隙中.忽略K+,该晶体的结构示意图如下四幅图所示:

根据甲图可得普鲁士蓝的化学式为 ,忽略K+,上述四幅晶体结构图中,图 是普鲁士蓝的晶胞.若把CN-看成直线,则该晶胞与《选修3》教材上的 (填化学式)的晶胞结构图高度类似.
(1)已知铁是26号元素,写出Fe2+的电子排布式
(2)已知三氯化铁固体在300℃以上可升华成含二聚三氯化铁(Fe2Cl6)分子的气体,该分子中所有原子均满足最外层8电子的稳定结构,则该分子的结构式为
(3)六氰合亚铁酸钾K4[Fe(CN)6]俗称黄血盐,它可用做显影剂,该化合物中存在的化学键类型有
(4)黄血盐溶液与Fe3+反应可生成一种蓝色沉淀,该物质最早由1704年英国普鲁士的一家染料厂的工人发现,因此取名为普鲁士蓝,化学式可表示为KxFey(CN)z.研究表明它的晶体的结构特征是Fe2+、Fe3+分别占据立方体的顶点,且自身互不相邻,而CN-位于立方体的棱上与Fe2+、Fe3+配位,K+填充在上述微粒形成的部分空隙中.忽略K+,该晶体的结构示意图如下四幅图所示:

根据甲图可得普鲁士蓝的化学式为
分析:(1)铁原子核外有26个电子,铁原子失去最外层电子生成亚铁离子,根据构造原理书写亚铁离子核外电子排布式;
(2)铁原子最外层2个电子,氯原子最外层7个电子,二聚三氯化铁(Fe2Cl6)分子中所有原子均满足最外层8电子的稳定结构,则3个氯原子和铁原子形成3个共价键,一个氯原子和铁原子形成配位键,据此写出其结构式;该分子中每个铁原子生成四个共价键,则铁原子和四个氯原子形成正四面体结构;
(3)K4[Fe(CN)6]中阴阳离子之间存在离子键,铁原子和配体之间存在配位键,非金属元素之间易形成共价键;氢氰根离子和CO为等电子体;根据价层电子对互斥理论确定其杂化类型;共价单键为α键,共价三键中含有一个α键和两个π键;
(4)利用均摊法确定其化学式;晶胞为其最小重复单位;根据丁的图知,与氯化钠晶胞相似.
(2)铁原子最外层2个电子,氯原子最外层7个电子,二聚三氯化铁(Fe2Cl6)分子中所有原子均满足最外层8电子的稳定结构,则3个氯原子和铁原子形成3个共价键,一个氯原子和铁原子形成配位键,据此写出其结构式;该分子中每个铁原子生成四个共价键,则铁原子和四个氯原子形成正四面体结构;
(3)K4[Fe(CN)6]中阴阳离子之间存在离子键,铁原子和配体之间存在配位键,非金属元素之间易形成共价键;氢氰根离子和CO为等电子体;根据价层电子对互斥理论确定其杂化类型;共价单键为α键,共价三键中含有一个α键和两个π键;
(4)利用均摊法确定其化学式;晶胞为其最小重复单位;根据丁的图知,与氯化钠晶胞相似.
解答:解:(1)铁原子核外有26个电子,铁原子失去最外层2个电子生成亚铁离子,根据构造原理知,亚铁离子的核外电子排布式为:1s22s22p63s23p63d6,故答案为:1s22s22p63s23p63d6;
(2)铁原子最外层2个电子,氯原子最外层7个电子,二聚三氯化铁(Fe2Cl6)分子中所有原子均满足最外层8电子的稳定结构,则3个氯原子和铁原子形成3个共价键,一个氯原子和铁原子形成配位键,所以其结构式为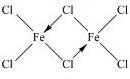 ;
;
该分子中每个铁原子生成四个共价键,则铁原子和四个氯原子形成正四面体结构,则该分子不是平面形结构,
故答案为 ;否;
;否;
(3)K4[Fe(CN)6]中钾离子和酸根离子之间存在离子键,铁原子和配体之间存在配位键,氮原子和碳原子之间易形成共价键;
氢氰根离子和CO为等电子体;HCN的结构式为H-C≡N,碳原子含有2个α键,所以碳原子为sp杂化;共价单键为α键,共价三键中含有一个α键和两个π键,则氢氰酸中含有2个α键和2个π键,
故答案为:ABD;CO;sp;2和2;
(4)氢氰根离子个数=12×
=3,亚铁离子个数=4×
=
,铁离子个数=4×
=
,则其化学式为KFe2(CN)6;晶胞为其最小重复单位,根据其重复知,丁为其晶胞;根据丁的图知,该晶胞中铁离子和亚铁离子个数都是4,与氯化钠晶胞相似,
故答案为:KFe2(CN)6;丁;NaCl.
(2)铁原子最外层2个电子,氯原子最外层7个电子,二聚三氯化铁(Fe2Cl6)分子中所有原子均满足最外层8电子的稳定结构,则3个氯原子和铁原子形成3个共价键,一个氯原子和铁原子形成配位键,所以其结构式为
 ;
;该分子中每个铁原子生成四个共价键,则铁原子和四个氯原子形成正四面体结构,则该分子不是平面形结构,
故答案为
 ;否;
;否;(3)K4[Fe(CN)6]中钾离子和酸根离子之间存在离子键,铁原子和配体之间存在配位键,氮原子和碳原子之间易形成共价键;
氢氰根离子和CO为等电子体;HCN的结构式为H-C≡N,碳原子含有2个α键,所以碳原子为sp杂化;共价单键为α键,共价三键中含有一个α键和两个π键,则氢氰酸中含有2个α键和2个π键,
故答案为:ABD;CO;sp;2和2;
(4)氢氰根离子个数=12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:KFe2(CN)6;丁;NaCl.
点评:本题考查了物质结构和性质,涉及晶胞的计算、等电子体、原子的杂化方式、配位键等知识点,会根据价层电子对互斥理论确定原子的杂化方式,会利用均摊法确定化学式,难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
现代社会,铁合金可说是金属材料王国的霸主,铁广泛存在于铁的氧化物及多种矿石中,如下表所示:
| 矿石名称 | 磁铁矿 | 黄铁矿 | 赤铁矿 | 黄铜矿 |
| 主要成分 | Fe3O4 | FeS2 | Fe2O3 | CuFeS2 |
请回答下列问题:
(1)在上表所列铁的化合物中,铁元素的质量分数含量最高的是 。
(2)工业上生产硫酸常以硫铁矿为原料,在沸腾炉中加热使硫元素转化为二氧化硫,其反应的方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
(3)生产硫酸的工业尾气中含有大量的SO2,若直接排放到大气中造成环境污染的后
果是 ,处理该尾气则可得到一种有价值的盐,请写出该盐的名称 。
(4)据统计,地球上每年由于腐蚀而消耗的铁约占铁的年产量的10%,铁发生腐蚀的主要原因是 (填写下面选项的序号)。
a. 直接与氧气发生了化学腐蚀
b. 通过原电池发生电化学腐蚀
c.与酸雨发生反应而消耗
若你选定选项a或c,请写出相应的化学方程式 ; 若
你选定选项b,请写出负极的电极反应式 。
