题目内容
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ΔH1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是__。
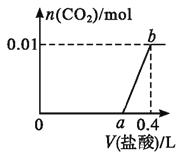
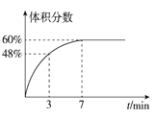
(2)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=__mol/(L·min),该温度下反应的平衡常数KP=__(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数__(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
【答案】2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-937.4kJ/mol 0.4 1.5 等于
【解析】
(1)根据盖斯定律计算反应热并书写热化学方程式;
(2)根据速率表达式v(SO2)=![]() ,平衡常数
,平衡常数![]() 及平衡移动原理分析解答。
及平衡移动原理分析解答。
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的反应方程式为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g),根据盖斯定律得此反应可由反应①×3-反应②得到,所以反应热为(-271.4kJ/mol×3)-123.2kJ/mol=-937.4kJ/mol,根据热化学方程式书写规则可得该反应热化学方程式为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-937.4kJ/mol,故答案为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-937.4kJ/mol;
(2)根据图示知曲线为SO2的体积分数,反应过程中气体体积不变,则3min时,生成二氧化硫的物质的量为n=5mol×48%=2.4mol,则v(SO2)= ;反应在7min后达到平衡,此时SO2的体积分数为60%,根据平衡常数的表达式得:
;反应在7min后达到平衡,此时SO2的体积分数为60%,根据平衡常数的表达式得:![]() ;该反应前后气体体积不变,则通入氧气时,平衡不移动,转化率不变,则氧气的体积分数等于原平衡时氧气的体积分数,故答案为:0.4;1.5;等于。
;该反应前后气体体积不变,则通入氧气时,平衡不移动,转化率不变,则氧气的体积分数等于原平衡时氧气的体积分数,故答案为:0.4;1.5;等于。