题目内容
【题目】氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
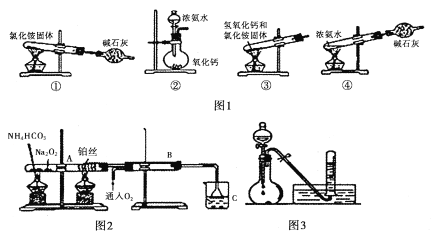
I. (1)图1为制取氨气的装置和选用的试剂,其中合理的是______________(填字母)。
A,①② B. ②③ C. ②④ D. ①③
(2)实验室制备氨气的化学方程式是____________________________________。
II. 图2位铵盐的受热分解装置
(1)被加热的铂丝处发生反应的化学方程式为____________________________________。
(2)B中出现的现象为_______________________________________________________。
(3)如图3:将上述烧杯C中反应得到酸的足量的浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____________________(写化学式)。
【答案】C 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 4NH3+5O2
CaCl2+2H2O+2NH3↑ 4NH3+5O2  4NO+6H2O 无色气体变成红棕色 NO
4NO+6H2O 无色气体变成红棕色 NO
【解析】
I、(1)①NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl;
②CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
③固体加热制气体时,试管口应略向下倾斜;
④根据浓氨水易挥发,可用碱石灰干燥分析;
(2)实验室用加热氯化铵和氢氧化钙制取氨气,二者反应生成氯化钙、氨气和水;
II、(1)在铂丝作催化剂、加热条件下,氨气和氧气发生氧化还原反应生成一氧化氮和水,反应方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)一氧化氮和氧气是无色气体,一氧化氮和氧气反应生成红棕色的二氧化氮,反应方程式为:2NO+O2=2NO2,所以看到的现象是:无色气体变成红棕色;
(3)HNO3是强电解质,具有强氧化性,可用铜反应,反应的离子方程式为Cu+4H++2NO3﹣=Cu2++2NO2↑+2H2O,实验完毕后,试管中收集到的气体的主要成分为NO。
I、(1)实验室制备氨气是利用氯化铵和氢氧化钙固体加热制取,化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2,
2NH3↑+2H2O+CaCl2,
①NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,故①错误;
②向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故②正确;
③固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,所以利用氯化铵和氢氧化钙固体加热制取氨气需试管口应略向下倾斜,故③错误;
④浓氨水易挥发,用浓氨水加热制取NH3的方法是正确的,氨气是碱性气体,可用碱石灰干燥,故④正确;故答案为D;
(2)实验室用加热氯化铵和氢氧化钙制取氨气,二者反应生成氯化钙、氨气和水,反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
II.(1)在铂丝作催化剂、加热条件下,氨气和氧气发生氧化还原反应生成一氧化氮和水,反应方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)一氧化氮和氧气是无色气体,一氧化氮和氧气反应生成红棕色的二氧化氮,反应方程式为:2NO+O2=2NO2,所以看到的现象是:无色气体变成红棕色,故答案为:无色气体变成红棕色;
(3)HNO3是强电解质,具有强氧化性,可用铜反应,反应的离子方程式为Cu+4H++2NO3﹣=Cu2++2NO2↑+2H2O,故实验完毕后,试管中收集到的气体的主要成分为NO,故答案为:NO。