题目内容
(14分)室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定该沉淀的组成,某研究性学习小组进行了以下实验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三: 。
(二)【理论探究】
假设二中只生成Cu(OH)2的原因是 (用一个离子方程式表示)。
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
(三)【实验探究】
步骤一:将CuSO4溶液加入到等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来。
步骤三:利用下图所示装置,选择必要的试剂,定性探究生成物的成分。
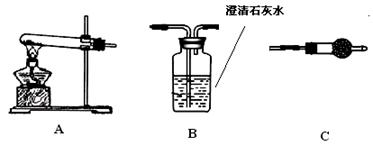
(1)各装置连接顺序为 。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
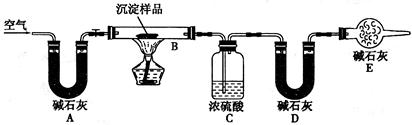
步骤四: 步骤三:利用下图所示装置,进行定量分析:
(4)①A装置中玻璃仪器的名称是 。
②实验开始时和实验结束时都要通入过量的空气其作用分别是
和 。
数据记录:
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,若所得沉淀是纯净物而不是混合物,通过计算写出该物质的化学式 。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三: 。
(二)【理论探究】
假设二中只生成Cu(OH)2的原因是 (用一个离子方程式表示)。
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
(三)【实验探究】
步骤一:将CuSO4溶液加入到等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来。
步骤三:利用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(1)各装置连接顺序为 。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。

步骤四: 步骤三:利用下图所示装置,进行定量分析:
(4)①A装置中玻璃仪器的名称是 。
②实验开始时和实验结束时都要通入过量的空气其作用分别是
和 。
数据记录:
| | B装置中样品的质量(g) | C装置的质量(g) | D装置的质量(g) |
| 实验前 | 33.3 | 262.1 | 223.8 |
| 试验后 | 24 | 264.8 | 230.4 |
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,若所得沉淀是纯净物而不是混合物,通过计算写出该物质的化学式 。
(14分)
(一)【提出假说】:生成的是CuCO3和Cu(OH)2的混合物(1分)
(二)【理论探究】:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑(2分);
(三)【实验探究】:(1)A→C→B (2分)
(2)无水硫酸铜 (2分)
(3)装置B中澄清石灰水变浑浊(2分)
(4)①U 形管;(1分)
②将装置中原有含水蒸气和CO2的空气排出;(1分)
将B中分解产生的水蒸气和CO2全部排出,被C、D装置完全吸收。(1分)
(四)【实验结论】:Cu2(OH)2CO3 (2分)。
(一)【提出假说】:生成的是CuCO3和Cu(OH)2的混合物(1分)
(二)【理论探究】:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑(2分);
(三)【实验探究】:(1)A→C→B (2分)
(2)无水硫酸铜 (2分)
(3)装置B中澄清石灰水变浑浊(2分)
(4)①U 形管;(1分)
②将装置中原有含水蒸气和CO2的空气排出;(1分)
将B中分解产生的水蒸气和CO2全部排出,被C、D装置完全吸收。(1分)
(四)【实验结论】:Cu2(OH)2CO3 (2分)。
试题分析:根据假设1和假设2推出假设3。氢氧化铜应为水解产物。
点评:本题属于难度较大综合性较强的物质推断题,完成此类题目,要注意分析题干所提供的信息,明确各种物质的性质,以及哪些因素对实验结果有影响,认真分析实验数据,仔细作答,还要注意平时知识的积累。

练习册系列答案
相关题目