题目内容
【题目】(1)乙烯使溴水褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型____(填“相同”或“不相同”)。
(2)用苯制备溴苯的化学方程式是____,该反应的类型___。
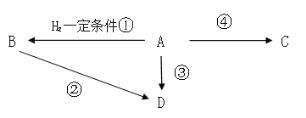
(3)已知2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
![]()
则反应②的化学方程式为___,该反应的类型为___。
【答案】不相同 ![]() +Br2
+Br2![]()
![]() +HBr 取代反应 2CH3CH2OH+O2
+HBr 取代反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应
【解析】
(1)乙烯与溴水发生加成反应使溴水褪色,酸性高锰酸钾溶液氧化乙烯使高锰酸钾溶液褪色,原理不同、反应类型不同;答案为:不相同。
(2)苯与液溴在Fe作催化剂下反应,苯环上的氢原子被溴原子代替生成溴苯和溴化氢,化学方程式为: 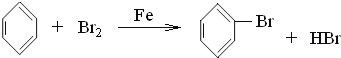 ,属于取代反应;答案为
,属于取代反应;答案为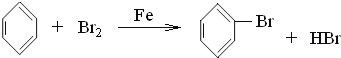 ,取代反应。
,取代反应。
(3)乙烯可以和水加成生成乙醇,所以A是乙醇,乙醇可以被氧化为B乙醛,乙醛易被氧化为C乙酸,乙醇催化氧化为乙醛的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,该反应类型是氧化反应;答案为2CH3CH2OH+O2
2CH3CHO+2H2O,该反应类型是氧化反应;答案为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,氧化反应。
2CH3CHO+2H2O,氧化反应。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某化学小组选用酸性高锰酸钾溶液和草酸(H2C2O4)溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录]
已知:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
_mol·L-1H2C2O4溶液 | H2O | 0.05 mol·L-1KMnO4溶液 | 3 mol·L-1稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
请回答:
(1)[实验原理]_____________(写离子方程式)。
(2)为完成实验目的,H2C2O4溶液的物质的量浓度不低于________。
(3)根据上表中的实验数据,可以得到的结论是_________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。

①该小组同学提出的假设是__________。
②请你帮助该小组同学完成实验方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量MnSO4 | 室温下溶液颜色褪至无色所需时间/min | |||
__mol·L-1 H2C2O4溶液 | H2O | 0.05 mol·L-1 KMnO4溶液 | 3 mol·L-1 稀硫酸 | |||
4 | 3.0 | 1.0 | 4.0 | 2.0 | 0.1 g | t |
若该小组同学提出的假设成立,应观察到的现象_____________。