题目内容
分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是( )
| A.①②③ | B.①③ | C.③④ | D.③ |
B
解析试题分析:①CuSO4是难挥发的强酸弱碱盐,溶液蒸干得到的任然是该物质本身。正确。②Na2O2放入水中发生反应得到的是NaOH。把溶液蒸干得到的是NaOH。错误。③NaCl是强酸强碱盐,在溶液中不水解。溶液蒸干得到的NaCl.正确。④Ca(HCO3)2是强碱弱酸盐,加热时水解产生的弱酸H2CO3会与碱发生反应Ca(OH)2得到正盐CaCO3。CaCO3难溶于水,所以把溶液蒸干得到的是CaCO3。错误。⑤FeCl3该盐水解FeCl3+3H2O  Fe(OH)3+3HCl产生的HCl有挥发性,会随着水分的蒸发而挥发,促使盐继续水解,最终得到的是Fe(OH)3。错误。
Fe(OH)3+3HCl产生的HCl有挥发性,会随着水分的蒸发而挥发,促使盐继续水解,最终得到的是Fe(OH)3。错误。
考点:考查盐溶液蒸干得到的固体与水解的规律的知识。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )
| A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(NH4+)<c(Cl-)<c(H+)<c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
| A.c(H+)=c(CHCOO-)+c(OH-) |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是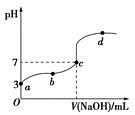
| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中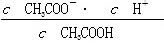 相等 相等 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。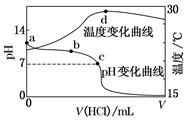
下列有关说法正确的是( )
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
B.b点:c(NH )+c(NH3·H2O)=c(Cl-) )+c(NH3·H2O)=c(Cl-) |
C.c点:c(Cl-)=c(NH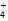 ) ) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )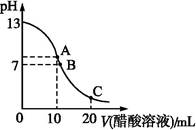
| A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
下列事实不属于盐类水解应用的是( )
| A.明矾、氯化铁晶体常用于净水或消毒 |
| B.实验室通常使用热的纯碱溶液去除油污 |
| C.实验室配制FeCl3溶液时加入少量稀盐酸 |
| D.实验室制氢气时加入CuSO4可加快反应速率 |
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患
者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10
下列推断正确的是( )
| A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子中毒 |
| D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃 |