题目内容
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
C
解析试题分析:A.PbS在溶液中存在沉淀溶解平衡:PbS(s)  pb2+(aq)+S2-(aq). 当溶液中存在CuSO4时,由于c(Cu2+)·c(S2-)>Ksp(CuS),产生沉淀铜蓝(CuS),发生沉淀的转化。这与二者的溶度积常数的大小无关。错误。B.在NaHS溶液中,存在电离平衡:HS-+H2O
pb2+(aq)+S2-(aq). 当溶液中存在CuSO4时,由于c(Cu2+)·c(S2-)>Ksp(CuS),产生沉淀铜蓝(CuS),发生沉淀的转化。这与二者的溶度积常数的大小无关。错误。B.在NaHS溶液中,存在电离平衡:HS-+H2O H+(aq)+S2-(aq)。当加入少量CuCl2粉末时,CuCl2电离产生Cu2+。由于溶液中c(Cu2+)·c(S2-)>Ksp(CuS),因此产生黑色沉淀,促进了电离平衡:HS-+H2O
H+(aq)+S2-(aq)。当加入少量CuCl2粉末时,CuCl2电离产生Cu2+。由于溶液中c(Cu2+)·c(S2-)>Ksp(CuS),因此产生黑色沉淀,促进了电离平衡:HS-+H2O H+(aq)+S2-(aq),最终溶液中c(H+)增大,则pH减小。错误。C.TiCl4是强酸弱碱盐,水解产生H2TiO3和HCl。当加热条件下并加入大量水促进TiCl4水解,HCl挥发,产生更多的H2TiO3。对固体减小加热灼烧,发生分解反应得到TiO2和水。所以可以制备TiO2固体。正确。 D.铜制器皿放置过程中会生成铜绿是由于铜器与其中含有的杂质及周围环境溶解在水膜中的氧气构成了原电池。由于Cu活泼,失去电子,溶解在水中的氧气得到电子而发生吸氧腐蚀的原因。错误。
H+(aq)+S2-(aq),最终溶液中c(H+)增大,则pH减小。错误。C.TiCl4是强酸弱碱盐,水解产生H2TiO3和HCl。当加热条件下并加入大量水促进TiCl4水解,HCl挥发,产生更多的H2TiO3。对固体减小加热灼烧,发生分解反应得到TiO2和水。所以可以制备TiO2固体。正确。 D.铜制器皿放置过程中会生成铜绿是由于铜器与其中含有的杂质及周围环境溶解在水膜中的氧气构成了原电池。由于Cu活泼,失去电子,溶解在水中的氧气得到电子而发生吸氧腐蚀的原因。错误。
考点:考查沉淀溶解平衡、盐的水解、电离及金属的电化学腐蚀的知识。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)> c(OH-),则下列有关说法或关系式一定正确的是( )
①HB-的水解程度小于HB-的电离程度;
②c(Na+)=0.1mol·L-1> c(B2-);
③溶液的pH=1;
④c(Na+)= c(HB-)+2c(B2-)+ c(OH-)
| A.①② | B.②③ | C.②④ | D.①②③ |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂: HIn(aq)(红色)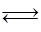 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是( )
| A.①②③ | B.①③ | C.③④ | D.③ |
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9]。下列说法正确的是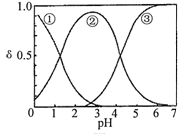
| A.曲线①代表的粒子是HC2O4- |
| B.0.1 mol·L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D.一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
下列说法正确的是( )
| A.25℃时 NH4Cl 溶液的 KW大于 100℃时 NaCl 溶液的 KW |
B.SO2通入碘水中,反应的离子方程式为 SO2+I2+2H2O=SO +2I-+4H+ +2I-+4H+ |
C.加入铝粉能产生 H2的溶液中,可能存在大量的 Na+、Ba2+、AlO 、NO 、NO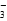 |
| D.100℃时,将 pH =2 的盐酸与 pH =12 的 NaOH 溶液等体积混合,溶液显中性 |
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
| A.[Na+]=[CH3COO-]+[CH3COOH] |
| B.[H+]=[CH3COO-]+[OH-] |
| C.[Na+]>[CH3COO-]>[OH-]>[H+] |
| D.[CH3COO-]>[Na+]>[H+]>[OH-] |
某温度下 ,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )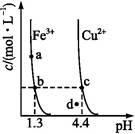
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |