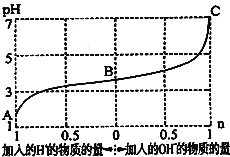
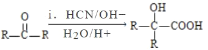题目内容
【题目】下列有关说法正确的是( )
A.常温下,![]() 的碱性溶液中不可能存在
的碱性溶液中不可能存在![]() 分子
分子
B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
C.![]() 溶液加水稀释,溶液的pH和
溶液加水稀释,溶液的pH和![]() 的电离度均增大
的电离度均增大
D.将![]() 溶液滴入含酚酞的
溶液滴入含酚酞的![]() 溶液,红色褪去,说明
溶液,红色褪去,说明![]() 溶液显酸性
溶液显酸性
【答案】C
【解析】
A.碳酸钠、碳酸氢钠溶液呈碱性,其pH可以为8,两溶液中都存在碳酸分子,故A错误;
B.![]() 的盐酸中氢离子抑制了水的电离,盐酸中氢氧根离子是水电离的,而氯化铵溶液中铵根离子促进了水的电离,溶液中氢离子是水电离的,两溶液中水的电离程度不相同,故B错误;
的盐酸中氢离子抑制了水的电离,盐酸中氢氧根离子是水电离的,而氯化铵溶液中铵根离子促进了水的电离,溶液中氢离子是水电离的,两溶液中水的电离程度不相同,故B错误;
C.![]() 溶液加水稀释,醋酸的浓度越小,电离程度越大,但是稀释后氢离子浓度减小,所以溶液的pH和
溶液加水稀释,醋酸的浓度越小,电离程度越大,但是稀释后氢离子浓度减小,所以溶液的pH和![]() 的电离度均增大,故C正确;
的电离度均增大,故C正确;
D.将![]() 溶液滴入含酚酞的
溶液滴入含酚酞的![]() 溶液,由于钡离子与碳酸根离子反应生成碳酸钡沉淀,导致碳酸根离子减少之至完全反应,所以溶液红色褪去,而
溶液,由于钡离子与碳酸根离子反应生成碳酸钡沉淀,导致碳酸根离子减少之至完全反应,所以溶液红色褪去,而![]() 溶液显中性,故D错误;
溶液显中性,故D错误;
故选C。

【题目】下列实验操作对应的现象与结论均正确的是( )
实验操作 | 现象 | 结论 | |
A | 常温下将 | 烧杯壁变凉 |
|
B | 向两支分别盛有 | 两支试管都有气泡产生 | 醋酸和硼酸的酸性比碳酸强 |
C | 将 | pH减小 | 稀释后 |
D | 常温下向物质的量浓度均为 | 先出现黄色沉淀 |
|
A.AB.BC.CD.D
【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
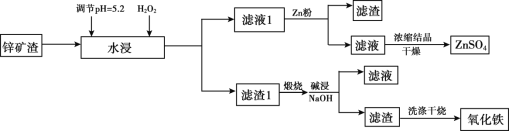
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
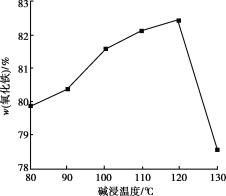
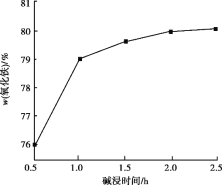
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
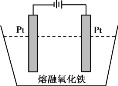
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。
【题目】室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
实验 | 操作 | 实验现象 |
Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2)
| 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
Ⅱ |
4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
Ⅲ |
| 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是________,产生原因是_________(用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
实验 | 操作 | 实验现象 |
Ⅳ |
| 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______。残余固体加入浓硝酸时,反应的化学方程式是________。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜(Cu2(OH)2SO4)是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是(Cu2(OH)2SO4);
ii.是Cu(OH)2和(Cu2(OH)2SO4)的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________有关。