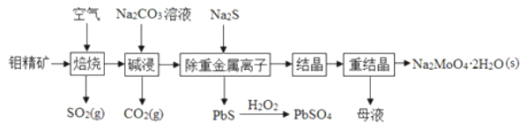
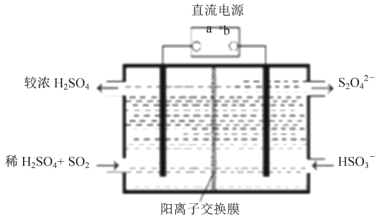
题目内容
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
【答案】C
【解析】原平衡相当于是4 mol SO2和1 mol O2,A相当于降低SO2的浓度,氧气转化率降低,平衡时SO3的物质的量小于W mol。B和原平衡是等效的,三氧化硫的浓度不变。C相当于是,4 mol SO2和2 mol O2,因此增大氧气的浓度,SO2的转化率增大,反应达到平衡时,SO3的物质的量大于W mol。D相当于4 mol SO2+0.5mol O2,即降低了氧气的浓度,转化率降低,平衡时SO3的物质的量小于W mol。所以答案选C。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某化学兴趣小组的同学利用酸碱滴定法测定某变质烧碱样品(含Na2CO3杂质)中 NaOH 的质量分数。实验步骤如下:
(I)迅速地称取烧碱样品0.50 g,溶解后配制成100 mL溶液,备用。
(II)将0.1000 mol·L1HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取 20.00mL 样品溶液于锥形瓶中,滴加 2 滴酚酞;以HCl 标准溶液滴定至第一终点,记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用 HCl 标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 22.22 | 22.18 | 22.20 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和__。酸式滴定管用蒸馏水洗净后、装入标准溶液并调零之前,应进行的操作是__。
(2)溶液中的H2CO3、![]() 、
、![]() 的物质的量分数随 pH 的变化如图所示:
的物质的量分数随 pH 的变化如图所示:

酚酞和甲基橙指示剂的变色pH范围及对应颜色见表。
酚酞 | 无色 pH < 8.0 | 粉红 pH 8.0~9.8 | 红 pH > 9.8 |
甲基橙 | 红 pH < 3.1 | 橙 pH 3.1~4.4 | 黄 pH > 4.4 |
①滴定至第一终点时,溶液中含碳微粒的主要存在形式为__。
②滴定至第一终点的过程中,发生反应的离子方程式为__。
③已知:pKa1= lgKa1,结合图像可知,H2CO3的pKa1约为__。
a.5.0 b.6.4 c.8.0 d.10.3
(3)下列有关滴定的说法正确的是__。
a.滴定至第一终点时,溶液中 c(H+)+c(Na+) = 2c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
b.滴定至第一终点时,溶液中 n(Cl) +n(![]() ) + n(
) + n(![]() ) + n(H2CO3) =n(Na+)
) + n(H2CO3) =n(Na+)
c.判断滴定至第二终点的现象是溶液由黄色变为橙色
d.记录酸式滴定管读数V1时,俯视标准液液面,会导致测得的NaOH质量分数偏低
(4)样品中NaOH的质量分数![]() (NaOH) =__%(计算结果保留小数点后 1 位)
(NaOH) =__%(计算结果保留小数点后 1 位)
【题目】A、B、C、D、E是元素周期表中前四周期的五种常见元素,其原子序数依次增大。详细信息见表,请回答下列问题:
① | A的一种核素在考古时常用来鉴定一些文物的年代 |
② | B的氧化物是导致光化学烟雾的主要物质之一 |
③ | C的某一种单质是空气的主要成分之一 |
④ | D的基态原子核外有6个原子轨道处于半充满状态 |
⑤ | E能形成红色的E2O和黑色的EO两种氧化物 |
(1)D的价电子排布式可表示为_______。
(2)BC3-的空间构型为____ (用文字描述)。
(3)根据等电子原理,AC分子的结构式为_____。
(4)1 mol AC2中σ键、π键数目之比为____。
(5)将白色的ESO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合离子。请写出生成此配合离子的离子方程式:____。
(6)E2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[E(NH3)4]2+中存在的化学键类型有____(填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②[E(NH3)4]2+具有对称的空间构型,[E(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[E(NH3)4]2+的空间构型为_____。其中,配体的杂化类型是_____。
(7)E的晶胞如下图所示,E为______堆积,空间利用率为_____,E晶体中每个E原子周围距离最近的E原子数目为____;已知E原子的半径为a nm,阿伏加德罗常数的值为NA,则E晶体的密度是_____g·cm-3。(列出算式即可)。