��Ŀ����
����Ŀ��ij�¶��£���2L�����ܱ������г���1.0mol A��1.0mol B��������Ӧ��A��g��+B��g��C��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ���������˵����ȷ���ǣ�������
t/s | 0 | 5 | 10 | 20 | 30 |
n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.��Ӧ��ǰ5 s��ƽ������v��A��=0.03 molL��1s��1
B.�ﵽƽ��ʱ��B��ת����Ϊ80%
C.��ͬ�¶��£�����ʼʱ�������г���2.0 mol C����ﵽƽ��ʱC��Ũ��С��0.2 molL��1
D.��ͬ�¶��£���ʼʱ�������г���0.20 mol A ,0.20 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰv��������v���棩
���𰸡�D
��������A����Ӧ��ǰ5 s��ƽ������v��A��= ![]() =
= ![]() =0.015 molL��1s��1����A���������⣻
=0.015 molL��1s��1����A���������⣻
B�����ݱ�������֪��20sʱ�÷�Ӧ�ﵽƽ��״̬�����ݷ���ʽ֪��n��A��=��n��B��=��1.0��0.80��mol=0.20mol��ת����= ![]() ��100%=
��100%= ![]() ��100%=20%����B���������⣻
��100%=20%����B���������⣻
C������1.0mol A��1.0mol B��ƽ��ʱn��A��=n��B��=0.80mol������n��C��=��n��A��=0.20mol����c��A��=c��B��= ![]() =0.40mol/L��c��C��=
=0.40mol/L��c��C��= ![]() =0.10mol/L����ѧƽ�ⳣ��K=
=0.10mol/L����ѧƽ�ⳣ��K= ![]() =0.625��
=0.625��
����ʼʱ�������г���2.0 mol C����ʣ��C�����ʵ���Ϊxmol��
A��g��+ | B��g�� | C��g�� | |
��ʼ��mol�� | 0 | 0 | 2.0 |
ת����mol�� | 2.0-x | 2.0-x | 2.0-x |
ƽ�⣨mol�� | 2.0-x | 2.0-x | x |
ƽ��ʱc��A��=c��B��= ![]() mol/L��c��C��=
mol/L��c��C��= ![]() mol/L��
mol/L��
�¶���ͬ��ѧƽ�ⳣ����ͬ������ 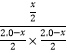 =0.625��
=0.625��
x=1.6��
���Դﵽƽ��ʱC��Ũ��= ![]() =0.8mol/L����C���������⣻
=0.8mol/L����C���������⣻
D���¶���ͬ��ƽ�ⳣ�����䣬���¶���ƽ�ⳣ��K= ![]() =
= ![]() =0.625����ʼʱ�������г���0.20mol A��0.20mol B��1.0mol C����ʱŨ����Qc=
=0.625����ʼʱ�������г���0.20mol A��0.20mol B��1.0mol C����ʱŨ����Qc= ![]() =50��K���ʷ�Ӧ���淴Ӧ���У���Ӧ�ﵽƽ��ǰv��������v���棩����D�������⣬
=50��K���ʷ�Ӧ���淴Ӧ���У���Ӧ�ﵽƽ��ǰv��������v���棩����D�������⣬
�ʴ�Ϊ��D��
A.����![]() ���㷴Ӧ���ʣ�
���㷴Ӧ���ʣ�
B.���ݻ�ѧ����ʽ����B��ת�����ʵ�����Ȼ��������ת���ʣ�
C.��������ʽ���㼴�ɣ�
D.����Ũ���غ�ƽ�ⳣ������Դ�С�ж�ƽ���ƶ��ķ���.