题目内容
【题目】下列条件下,对应离子一定能大量共存的是( )
A.在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42﹣、NO3﹣
B.常温下, ![]() =0.1mol/L的溶液中:K+ , Cl﹣ , Fe2+ , NO3﹣
=0.1mol/L的溶液中:K+ , Cl﹣ , Fe2+ , NO3﹣
C.使甲基橙变红的溶液中:NH4+ , Cl﹣ , SO2﹣ , Mg2+
D.25℃时,水电离出的c(H+)=1×10﹣13mol/L:K+ , Ba2+ , NO3﹣ , S2﹣
【答案】C
【解析】A.NaHCO3、Al3+之间发生双水解反应,在溶液中不能大量共存,故A不符合题意;
B.该溶液呈碱性,Fe2+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故B不符合题意;
C.使甲基橙变红的溶液中存在大量氢离子,NH4+、Cl﹣、SO42﹣、Mg2+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故C符合题意;
D.25℃时水电离出的c(H+)=1×10﹣13mol/L的溶液呈酸性或碱性,S2﹣与氢离子反应,NO3﹣在酸性条件下能够氧化S2﹣,在酸性溶液中不能大量共存,故D不符合题意;
所以答案是:C.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,发生反应:A(g)+B(g)C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表,下列说法正确的是( )
t/s | 0 | 5 | 10 | 20 | 30 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.03 molL﹣1s﹣1
B.达到平衡时,B的转化率为80%
C.相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 molL﹣1
D.相同温度下,起始时向容器中充入0.20 mol A ,0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
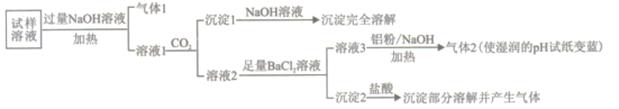
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
【题目】化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为;乙是实验需要测量的物理量,则表 格中“乙”应填写 .
(2)【测定 H2C2O4xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000molL﹣1 的 KMnO 标准溶液进行滴定;
请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是(选填 a、b).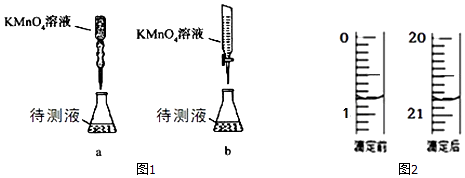
(4)由图2可知消耗 KMnO4溶液体积为mL;
(5)滴定过程中眼睛应注视;
(6)通过上述数据,求得 x= . 以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果(偏大、偏小或没有影响).
