题目内容
16.可以将氧化还原反应2H2+O2=2H2O设计成原电池,若 KOH溶液作电解质溶液,则正极反应式为O2+4e-+2H2O=4OH-.若把H2改为甲烷,KOH溶液作电解质溶液,则负极反应式为CH4+10OH--8e-=CO32-+7H2O.分析 所有燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,如果是氢氧燃料碱性电池,正极上氧气得电子生成氢氧根离子;如果是甲烷燃料碱性电池,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水.
解答 解:所有燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,如果是氢氧燃料碱性电池,正极上氧气得电子生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-;如果是甲烷燃料碱性电池,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e-=CO32-+7H2O;
故答案为:O2+4e-+2H2O=4OH-;CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,电极反应式的书写也是学习难点,注意结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
相关题目
6.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 使用催化剂能加快化学反应速率,提高产率 | |
| C. | 用氨的催化氧化法生产硝酸使用过量空气以提高氨气的利用率 | |
| D. | 实验室用排饱和食盐水法收集氯气 |
4.下列叙述不正确的是( )
| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 适量油脂,有助于人体吸收多种脂溶性维生素 | |
| C. | 油脂水解的共同产物是甘油 | |
| D. | 天然油脂是纯净物,有固定的熔沸点 |
11.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2. 下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 | |
| C. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O | |
| D. | 电池充电过程中,阴极附近溶液的pH降低 |
1.下列哪些材料是传统无机材料( )
| A. | 玻璃、水泥 | B. | 液晶材料、纳米材料 | ||
| C. | 塑料、橡胶 | D. | 半导体材料、绝缘体材料 |
8.下列关于胶体和溶液的说法中,正确的是( )
| A. | 向煮沸的NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 胶粒带有电荷,但是整个分散系仍是电中性的 | |
| D. | 胶体粒子很小,可以透过半透膜 |
14.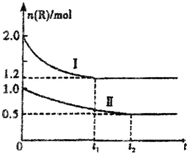 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )| A. | 将甲升温,可使甲和乙中各物质的体积分数达到相同 | |
| B. | x=2,且M、N中仅有一种为气态 | |
| C. | 曲线II为甲中R的物质的量一时间图象 | |
| D. | 其他条件不变时,向乙中再加入1mol M、1molN,达到新平衡时,则有1.0mol<n(R)<1.2 mol |