题目内容
单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
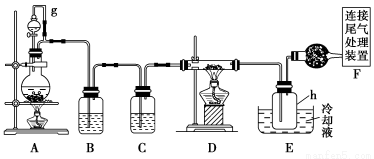
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 ____________________________。
(2)装置A中g管的作用是________;装置C中的试剂是________;装置E中的h瓶需要冷却的理由是________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由______________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。
(1)MnO2+4H++2Cl-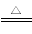 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)平衡压强 浓硫酸 使SiCl4冷凝 (3)Al、P、Cl
(4)①否 KMnO4溶液自身可作指示剂 ②4.480%
【解析】(1)A装置是制备Cl2的,注意要求写的是MnO2与浓盐酸的“离子方程式”。
(2)装置A中“g”管的作用是“使分液漏斗与圆底烧瓶压强保持一致,便于液体顺利滴下”,简单说就是“平衡压强”。B是除杂装置,除去Cl2中的HCl气体,C就是干燥装置。干燥Cl2一般用浓硫酸。由于反应温度是450~500 ℃,此时SiCl4是气体,而题目表格中SiCl4通常应是液态的,故装置E中h瓶需要冷却的理由应是便于分离得到SiCl4。
(3)根据已知条件AlCl3、FeCl3、PCl5都会在精馏后的残留物中存在,注意要先答上Cl,容易遗漏。
(4)①由于紫色的KMnO4溶液反应后颜色会褪去,所以不用滴加指示剂。
②根据KMnO4的用量计算出Fe2+的用量,再算其质量分数,属于典型的常见计算,略。