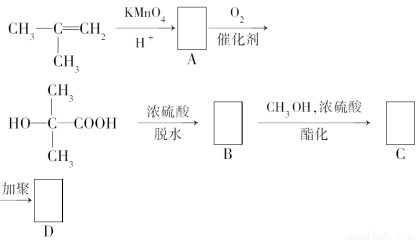
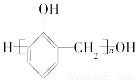
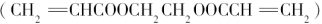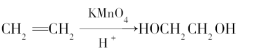题目内容
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。请完成(1)~(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)与铁反应生成铜]。试写出该反应的化学方程式: _____________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:____________________________。
这层铜绿可以用化学方法除去,试写出除去铜绿而不损伤器物的化学方程式: _________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃)_________________ ___________。
(1)Fe+CuSO4=FeSO4+Cu
(2)2Cu+O2+H2O+CO2=Cu2(OH)2CO3
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
(3)选择铜做货币是因为铜的熔点比较低,容易铸造成型;铜的化学性质比较稳定,不易被腐蚀
【解析】本题考查有关铜的冶炼方法、铜化合物的性质,同时考查了有关铜的
应用。一方面要注意铜的性质很稳定,不易发生化学反应。但又应知道这种
稳定性是相对的,在适宜条件下也会与一些物质反应。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案某研究小组设计如下工艺路线提纯工业碳酸钠。已知工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42—等杂质。
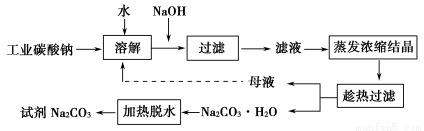
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ.有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
根据所给信息,回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为___________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=__________________________________________
(2)“趁热过滤”时的温度应控制在____________________________________
(3)有人从“绿色化学”的角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行__________________,并说明理由_______________________________________
单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
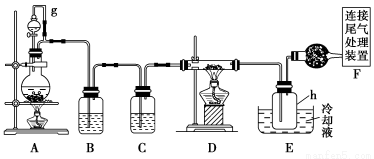
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 ____________________________。
(2)装置A中g管的作用是________;装置C中的试剂是________;装置E中的h瓶需要冷却的理由是________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由______________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。