题目内容
【题目】某溶液中含大量Fe2+、Al3+、Fe3+、Na+、Cl﹣、SO ![]() 离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )
A.Na+、Fe2+
B.Al3+、SO ![]()
C.Fe3+、SO ![]()
D.Al3+、Cl﹣
【答案】B
【解析】解:A、因为Na2O2是强氧化剂,而且遇水生成NaOH,钠离子浓度增大,故A错误;B、Na2O2是强氧化剂,而且遇水生成NaOH,铝离子能和过量的氢氧化钠反应生成四羟基合铝酸根离子,在盐酸作用下又会生成铝离子,根据铝元素守恒,则铝离子量不变,硫酸根离子自始至终不发生变化,故B正确;
C、因为Na2O2是强氧化剂,而且遇水生成NaOH,于是Fe2+氧化成Fe3+ , 并沉淀,再和盐酸反应生成三价铁离子,所以三价铁离子浓度增大,故C错误;
D、加入足量的盐酸溶解沉淀,氯离子浓度增大,故D错误.
故选B.
溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,Fe2+氧化成Fe3+ , 减少的是亚铁离子,增加的是三价铁离子、钠离子、氯离子,铝离子、硫酸根离子保持不变.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,下列关于试管中的现象描述不正确的是( )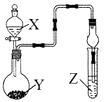
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 稀硫酸 | Na2O2 | 氢硫酸 | 产生淡黄色沉淀 |
B | 浓氨水 | 碱石灰 | 氯化铝溶液 | 产生白色沉淀 |
C | 浓硝酸 | Cu | 硅酸钠溶液 | 产生白色沉淀 |
D | 稀盐酸 | CaCO3 | 氯化钡溶液 | 产生白色沉淀 |
A.A
B.B
C.C
D.D