题目内容
11.氮及其化合物在工农业生产、生活中有着重要作用.(1)实验室制氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)氨水常作沉淀剂,25℃时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33,向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中加入氨水,首先生成的沉淀是Fe(OH)3(填化学式).
(3)常温下,若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/l,则c(SO42-)=$\frac{a}{2}$mol/L.
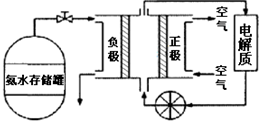
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择碱性(填“酸性”、“碱性”或“中性”)溶液.
②空气在进入电池装置前需要通过过滤器除去的气体是CO2.
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应式是O2+4e-+2H2O=4OH-.
分析 (1)实验室常用加热氯化铵和氢氧化钙的混合物制取氨气;
(2)溶度积常数越小的越先产生沉淀;
(3)常温下混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒c(H+)+c(NH4+)=c(OH-)+2c(SO42-)判断硫酸根离子浓度;
(4)①氨气是碱性气体;
②空气中的CO2能和氨水反应;
③生成的无毒气体时N2,据此书写化学方程式;正极发生氧化反应,氧气在正极反应,注意时碱性环境.
解答 解:(1)实验室常用加热氯化铵和氢氧化钙的混合物制取氨气,反应方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(2)溶度积常数越小的物质越先沉淀,所以Fe(OH)3先沉淀,故答案为:Fe(OH)3;
(3)常温下混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒c(H+)+c(NH4+)=c(OH-)+2c(SO42-),所以c(SO42-)=$\frac{a}{2}$mol/L,
故答案为:$\frac{a}{2}$mol/L;
(4)①氨气是碱性气体,所以电解液最好选择碱性的,故答案为:碱性;
②空气中的CO2能和氨水反应,所以,滤去的气体是CO2,故答案为:CO2;
③正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
点评 本题以氨气为载体考查氨气制取、难溶物溶解平衡、离子浓度计算、原电池原理等知识点,综合性较强,明确原电池原理、盐类水解原理、难溶物溶解平衡原理等即可解答,难点是电极反应式的书写,要结合电解质溶液酸碱性书写.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-akJ•mol-1
按上述转化,标准状况下44.8L NO2被还原至N2,整个过程中放出的热量为867kJ,则a的值为( )
| A. | 1160 | B. | 2308 | C. | 1441 | D. | 2320 |
| A. | 有单质参加的反应,置换反应一定都属于氧化还原反应 | |
| B. | 简单非金属阴离子只有还原性,而金属阳离子只有氧化性 | |
| C. | 离子化合物在熔融态都能够导电,共价化合物在熔融态都不导电 | |
| D. | 所有物质都有化学键 |
| A. | 甘油 | B. | 醋酸 | C. | 甲醇 | D. | 乙醛 |
 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.
利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.

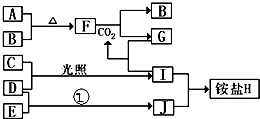 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应. .
. 2NH3的化学方程式.
2NH3的化学方程式.