题目内容
【题目】在高温高压下碳氧化物具有极高的化学活性,能与多种单质或化合物反应。
(1)一定条件下,CO与H2 可合成甲烷,反应方程式为:CO(g)+3H2(g) ![]() CH4(g)+ H2O(g)
CH4(g)+ H2O(g)
①一定条件下,该反应能够自发进行的原因是_________
②已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8kJ/mol 283.0kJ/mol和890.0kJ/mol。
写出CO 与H2 反应生成CH4 和CO2 的热化学方程式:_____________。
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
反应Ⅱ: CO2 (g) +3H2 (g) ![]() CH3OH (g) +H2O (g)
CH3OH (g) +H2O (g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为______________。
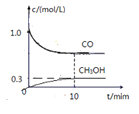
②一定温度下,在体积可变的密闭容器中加入4molH2和一定量的CO发生反应Ⅰ,开始时容器体积为2L,CO 和CH3OH (g) 的浓度随时可变化如图。10min 达到平衡,则反应1的化学平衡常数为____________。
③恒温恒容条件下,在密闭容器中等物质的量的通入CO2 和H2, 下列描述能说明反应Ⅱ已经达到平衡状态的是___。(填标号)
A.容器内CO2的体积分数不再变化
B.当CO2和H2转化率的比值不再变化
C.单位时间CH3OH分子断裂5NA个共价键,同时断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量为34.5,且保持不变
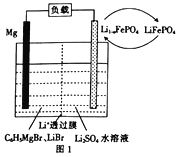
(3)甲烷碱性燃料电池装置如图所示(开始时两边溶液质量相等),用电器为惰性电极电解装置,其原理是:通电后,将Co2+氧化成Co3+,进而彻底氧化CN-为无害气体使废水得以净化。
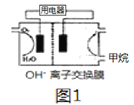
①当除去1molCN-时,图1两边质量差为__________g.
②负极电极反应式为__________.
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1KJ/mol,科研人员对该反应进行了研究.部分研究结果如下:
HCOOCH3(g) ΔH=-29.1KJ/mol,科研人员对该反应进行了研究.部分研究结果如下:
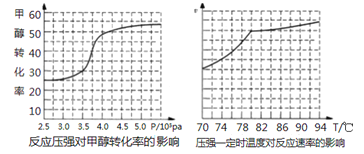
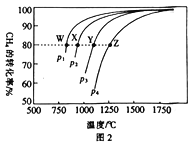
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是_____。
②实际工业生产中采用的温度是80℃,其理由是___________。
【答案】 该反应ΔH <0 2CO (g)+2H2(g) ![]() CH4(g)+CO2(g)ΔH=-247.6kJ/mol 反应I符合“原了经济性”的原则即原了利用率为100% 25/243 ABCD 140g CH4+ 10OH+-8e-=CO32-+7H2O 4.0×106Pa 高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低
CH4(g)+CO2(g)ΔH=-247.6kJ/mol 反应I符合“原了经济性”的原则即原了利用率为100% 25/243 ABCD 140g CH4+ 10OH+-8e-=CO32-+7H2O 4.0×106Pa 高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低
【解析】本题主要考查有关化学平衡的判断和计算。
(1)①一定条件下,反应能够自发进行,△H–T△S<0,该反应△S<0,所以该反应能够自发进行的原因是△H<0。
②由H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和890.0kJ/mol得2H2(g) +O2(g)![]() 2H2O(l)ΔH=-571.6kJ/mol,2CO(g)+O2(g)
2H2O(l)ΔH=-571.6kJ/mol,2CO(g)+O2(g)![]() 2CO2(g)ΔH=-566kJ/mol,CO2(g)+2H2O(l)
2CO2(g)ΔH=-566kJ/mol,CO2(g)+2H2O(l)![]() CH4(g)+2O2(g)ΔH=+890.0kJ/mol,将以上3个热化学方程式相加可得CO与H2反应生成CH4和CO2的热化学方程式:2CO(g)+2H2(g)
CH4(g)+2O2(g)ΔH=+890.0kJ/mol,将以上3个热化学方程式相加可得CO与H2反应生成CH4和CO2的热化学方程式:2CO(g)+2H2(g)![]() CH4(g)+CO2(g)ΔH=-247.6kJ/mol。
CH4(g)+CO2(g)ΔH=-247.6kJ/mol。
(2)①在以上制备甲醇的两个反应中,反应Ⅰ优于反应Ⅱ,原因为反应I符合“原了经济性”的原则即原子利用率为100%。
②开始时,c(CO)=1.0mol/L,所以n(CO)=2mol,设容器平衡体积为VL,定温定压,气体物质的量之比等于体积之比,6:(6-0.6V)=2:V,V=![]() 。
。
平衡时,c(CH3OH)=0.3mol/L,n(CH3OH)=0.3×![]() mol=0.5mol,c(CO)=(2-0.5)×
mol=0.5mol,c(CO)=(2-0.5)×![]() mol/L=0.9mol/L,c(H2)=(4-1)×
mol/L=0.9mol/L,c(H2)=(4-1)×![]() mol/L=1.8mol/L,则反应1的化学平衡常数为
mol/L=1.8mol/L,则反应1的化学平衡常数为![]() =
=![]() 。
。
③A.容器内CO2的体积分数随着反应进行而变化,当容器内CO2的体积分数不再变化时,反应达到平衡状态,故A能说明反应Ⅱ已经达到平衡状态;B. CO2和H2的配比不等于化学计量数之比,CO2和H2转化率的比值随着反应进行而变化,当CO2和H2转化率的比值不再变化,反应达到平衡状态,故B能说明反应Ⅱ已经达到平衡状态;C.单位时间CH3OH分子断裂5NA个共价键,有1molCH3OH参加反应,同时断裂3NA个H-H键,有3molH2参加反应,正反应速率等于逆反应速率,故C能说明反应Ⅱ已经达到平衡状态;D.容器内混合气体的质量守恒,物质的量随着反应进行而变化,混合气体的平均相对分子质量也随之变化,当混合气体的平均相对分子质量为34.5且保持不变时,反应达到平衡状态,故D能说明反应Ⅱ已经达到平衡状态。故选ABCD。
(3)①CN-被氧化为二氧化碳和氮气,5CH4~10O2~8CN-~8CO2~4N2~40e-~40OH/span>-(移动的),OH-由左向右移动,正极室溶液增加参加反应的氧气的质量,减少移动的OH-的质量,负极室溶液增加参加反应的甲烷的质量和移动的OH-的质量,图1两边质量差为(5×16+2×40×17-32×10)g/8=140g。
②负极电极反应式为CH4+10OH+-8e-=CO32-+7H2O。
(4)①从反应压强对甲醇转化率的影响“效率”看,压强大于4.0×106Pa时,转化率随压强增大提高很小,所以工业制取甲酸甲酯应选择的压强是4.0×106Pa。
②实际工业生产中采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案