题目内容
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
(1)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g) △H=-1143 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
则2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=___________kJ·mol-1。
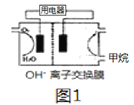
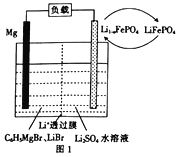
(2)一种镁一锂双离子二次电池的装置如图1所示。
①放电时, Mg 电 极 为___________ (填“ 正极”或“负极” ), Li +迁 移 至___________ (填“正极区”或“负极区”)。
②充电时,阳极的电极反应式为_______________________________。
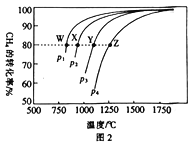
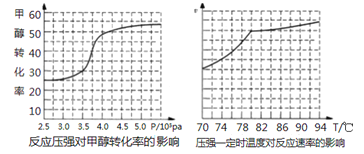
(3)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
①图中p1、p2、p3、p4 代表不同压强,压强最大的是___________。该反应的△H___________(填“>"“<”或“=”下同)0。
②压强为p4时,在Y点:v(正)___________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、k3、K4由大到小的顾序为_____________。
【答案】 -659 负极 正极区 LiFePO4-xe-=Li1-xFePO4+xLi+ p4 > < K4>K3>K2>K1
【解析】(1)①2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g)△H=-1143kJ·mol-1,②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1,根据盖斯定律:①-②得:2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=(-1143kJmol-1)-(-484kJmol-1)=-659kJmol-1,故答案为:-659;
(2)①根据图示,放电时,Mg电极失去电子发生氧化反应,镁为负极;原电池中阳离子向正极移动,则锂离子电池放电时,Li+向正极迁移,故答案为:负极;正极区;
②根据图示可知,充电时,阳极的电极上LiFePO4失电子,电极反应式为:LiFePO4-xe-═xLi++Li1-xFePO4,故答案为:LiFePO4-xe-═xLi++Li1-xFePO4;
(3)①反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),增大压强,平衡逆向移动,甲烷的转化率减小,即压强越大,甲烷的转化率越小,因此p1、p2、p3、p4代表不同压强,压强最大的是p4;根据图像,升高温度,甲烷的转化率增大,说明平衡正向移动,则正反应为吸热反应,△H>0,故答案为:p4;>;
2CO(g)+2H2(g),增大压强,平衡逆向移动,甲烷的转化率减小,即压强越大,甲烷的转化率越小,因此p1、p2、p3、p4代表不同压强,压强最大的是p4;根据图像,升高温度,甲烷的转化率增大,说明平衡正向移动,则正反应为吸热反应,△H>0,故答案为:p4;>;
②压强为p4时,Y点不是平衡状态,要达到平衡状态,反应需要逆向进行,因此v(正)<v(逆) ,故答案为:<;
③该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,因此图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顾序为K4>K3>K2>K1,故答案为:K4>K3>K2>K1。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案