题目内容
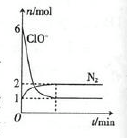
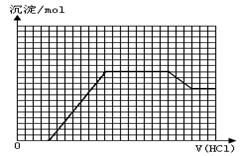
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种。取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示。下列判断正确的是

| A.原溶液中可能含有NH4+、SO42- |
| B.最终溶液中最少含2种溶质 |
| C.原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D.滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
B
试题分析:无色溶液首先排除MnO4-、Cu2+ 、Fe3+,根据图像,刚开始滴加盐酸无沉淀,说明有OH-,也就没有HCO3-、Mg2+、 NH4+,继续滴加盐酸有沉淀产生,但是沉淀增加到一定值时不再变化,一段时间后减少,说明一定有AlO2-、SiO32-、CO32-,根据电荷守恒,Na+一定有,SO42-可能有,A错误;B正确;
C、n(NaAlO2)与n(Na2CO3)的比值和消耗盐酸体积有关系,看沉淀溶解,消耗盐酸体积为3格,是AlO2-转换为Al(OH)3,与盐酸反应;中间沉淀不变消耗盐酸体积为8格,是CO32-与盐酸反应生成CO2,则比值为3:4,错误;D、开始时是OH-和H+反应生成水,错误。

练习册系列答案
相关题目