题目内容
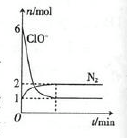
甲容器中发生了某化学反应,测得反应过程中,容器中存在Na+、H2O、CN-、ClO-、HCO3-、N2、Cl-七种粒子,其中ClO-和N2的物质的量随时间变化的曲线如图所示。根据题意完成下列填空:
(1)CN一中氮元素的化合价是 。
(2)甲容器中发生反应的离子方程式是 。该反应的氧化产物是 (填化学式)。
(3)乙容器中用ClO2代替ClO-,溶液呈碱性,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为 。

(1)CN一中氮元素的化合价是 。
(2)甲容器中发生反应的离子方程式是 。该反应的氧化产物是 (填化学式)。
(3)乙容器中用ClO2代替ClO-,溶液呈碱性,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为 。
(1)-3
(2)5ClO-+2CN-+H2O=N2↑+2HCO3-+5Cl-(写可逆符号也给分);N2、HCO3-
(3)5∶2(每空2分)
(2)5ClO-+2CN-+H2O=N2↑+2HCO3-+5Cl-(写可逆符号也给分);N2、HCO3-
(3)5∶2(每空2分)
试题分析:(1)非金属性C<N,所以氮元素的化合价是-3
(2)根据题意:5ClO-+2CN-+H2O=N2↑+2HCO3-+5Cl-(写可逆符号也给分);该反应的氧化产物是N2、HCO3-
(3)最终都被还原为Cl-,ClO2得5个电子,ClO-得2个电子,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为5∶2。

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
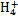 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C 、S
、S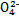 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
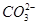 ;⑦
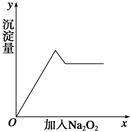
;⑦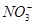 中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是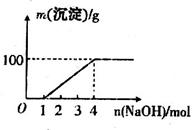
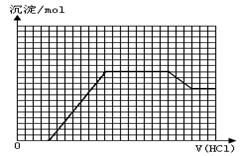
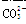 、
、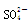 、
、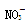 等离子中的若干种。现做如下实验:
等离子中的若干种。现做如下实验: