题目内容
【题目】如图所示2套实验装置,分别回答下列问题。
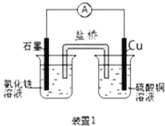
(1)装置1中的Cu是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________。
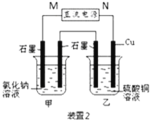
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为_________极,甲烧杯右边石墨电极附近首先变红的原因是___________________。
② 乙烧杯中电解反应的离子方程式为____________。
③ 若装置甲阴、阳两极各产生112mL气体(标准状况),则装置乙所得溶液的pH为______(忽略反应前后溶液的体积变化)。
【答案】负 2Fe3++ Cu=2Fe2++Cu2+ 正 H2O![]() H++OH-,H++2e-=H2↑,c(OH-)>c(H+),溶液呈碱性 2Cu2++ 2H2O
H++OH-,H++2e-=H2↑,c(OH-)>c(H+),溶液呈碱性 2Cu2++ 2H2O![]() 2Cu + O2↑ + 4H+ 1
2Cu + O2↑ + 4H+ 1
【解析】
(2)向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极生成OH-,应为电解池的阴极,则M为电源的正极,N为电源的负极,甲为电解食盐水装置,乙为电解硫酸铜装置。
(1)装置1为原电池,铜为负极,被氧化,石墨为正极,电池反应为2Fe3++Cu═2Fe2++Cu2+;
(2)①由分析可知M为正极,阴极上分别发生H2O![]() H++OH-、2H++2e-═H2↑,c(OH-)>c(H+),溶液呈碱性;
H++OH-、2H++2e-═H2↑,c(OH-)>c(H+),溶液呈碱性;
②乙为电解硫酸铜溶液,阳极生成氧气,阴极生成铜,电解的方程式为2Cu2++2H2O 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③甲装置中电解氯化钠溶液,阳极生成氯气,阴极生成氢气,若装置甲阴、阳两极各产生112mL气体(标准状况),则n(H2)=![]() =0.005mol,由2H++2e-═H2↑可知转移0.01mol电子,由2Cu2++2H2O
=0.005mol,由2H++2e-═H2↑可知转移0.01mol电子,由2Cu2++2H2O 2Cu+O2↑+4H+可知,生成0.01molH+,则c(H+)=
2Cu+O2↑+4H+可知,生成0.01molH+,则c(H+)=![]() =0.1mol/L,pH=1。
=0.1mol/L,pH=1。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 硫酸 |
pH | 11 | 11 | 3 | 3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
【题目】80℃时,1L 密闭容器中充入0.20 mol N2O4,发生反应N2O4![]() 2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L﹣1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度该反应的平衡常数K减小
B. 20~40s 内,v(N2O4)= 0.004 mol·L-1·s-1
C. 100s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
D. 反应达平衡时,吸收的热量为0.15Q kJ