题目内容
【题目】右图是可逆反应A+2B ![]() 2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是
2C + 3D 的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是

A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
【答案】B
【解析】
根据速率时间图,达到平衡后加压,正、逆反应速率都加快,说明反应物、生成物中均有气体,平衡正向移动,根据平衡移动原理可知正反应是气体分子数目减小的反应;根据化学反应左右两边的系数,若D为气体,该反应正向不会是气体分子数目减小的反应,故D一定不是气体、C一定是气体;由于C是气体,故A、B必须同时是气体才能满足正反应是气体分子数目减小的反应;达到平衡后降温,平衡正向移动,根据平衡移动原理可知正向是放热反应;故ACD说法正确,B说法错误;答案选B。

【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g) + 3H2(g) ![]() 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1 ________K2(填写“>”、“=”或“<”)
(2) 400℃时,反应2NH3(g) ![]() N2(g) + 3H2(g)的化学平衡常数的值为_____________。
N2(g) + 3H2(g)的化学平衡常数的值为_____________。
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) ___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______(填“增大”、“减小”或“不变”),其原因是_________________________________________________________。
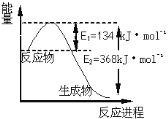
(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式 _____________________________________________。