题目内容
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
完成下列填空:
(1)上述过程CCl4层在试管中位于
(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

(3)把KI换成KBr,则CCl4层变为
完成下列填空:
(1)上述过程CCl4层在试管中位于
下
下
(填上、下)层,分离CCl4层和水层的操作名称是分液
分液
,使用仪器是分液漏斗、烧杯
分液漏斗、烧杯
.(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

(3)把KI换成KBr,则CCl4层变为
橙
橙
色,该反应的离子方程式为Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3
HBrO3>Cl2>HIO3
.分析:(1)四氯化碳和水不互溶,且密度大于水,该操作名称是分液,使用分液漏斗进行分离,用烧杯盛放溶液;
(2)氯气具有强氧化性,碘能被氯气氧化生成碘酸,同时氯气被还原生成氯化氢;
(3)氯气的氧化性大于溴,所以氯气能氧化溴离子生成溴单质,溴水呈橙色,同一氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,以此分析.
(2)氯气具有强氧化性,碘能被氯气氧化生成碘酸,同时氯气被还原生成氯化氢;
(3)氯气的氧化性大于溴,所以氯气能氧化溴离子生成溴单质,溴水呈橙色,同一氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,以此分析.
解答:解:(1)四氯化碳和水不互溶,且密度大于水,所以四氯化碳在水下层,该操作名称是分液,使用分液漏斗进行分离,用烧杯盛放溶液;
故答案为:下,分液,烧杯和分液漏斗;
(2)氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,反应物为氯气和碘、水,生成物是碘酸和氯化氢,一个氯气分子参加反应得2个电子,一个碘分子参加反应失去10个电子,该反应中得失电子的最小公倍数是10,所以方程式为I2+5Cl2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H20=2HIO3+10HCl;
(3)氯气的氧化性大于溴,所以氯气能氧化溴离子生成溴单质,发生的离子反应方程式为Cl2+2Br-=Br2+2Cl-,溴水呈橙色,继续向溴水中滴加氯水,CCl4层的颜色没有变化,说明氯气的氧化性小于溴酸,氯气能和碘反应生成碘酸,所以氯气的氧化性大于碘酸,所以Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3;
故答案为:橙,Cl2+2Br-=Br2+2Cl-,HBrO3>Cl2>HIO3.
故答案为:下,分液,烧杯和分液漏斗;
(2)氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,反应物为氯气和碘、水,生成物是碘酸和氯化氢,一个氯气分子参加反应得2个电子,一个碘分子参加反应失去10个电子,该反应中得失电子的最小公倍数是10,所以方程式为I2+5Cl2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H20=2HIO3+10HCl;
(3)氯气的氧化性大于溴,所以氯气能氧化溴离子生成溴单质,发生的离子反应方程式为Cl2+2Br-=Br2+2Cl-,溴水呈橙色,继续向溴水中滴加氯水,CCl4层的颜色没有变化,说明氯气的氧化性小于溴酸,氯气能和碘反应生成碘酸,所以氯气的氧化性大于碘酸,所以Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3;
故答案为:橙,Cl2+2Br-=Br2+2Cl-,HBrO3>Cl2>HIO3.
点评:本题考查了氧化还原反应,明确同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
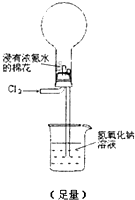 通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
