题目内容
反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
A
试题分析:根据方程式可知反应前后体积不变,则可以设容器的体积是1L,则根据平衡常数的表达式可知
 <1,所以反应没有达到平衡状态,此时锌正反应方向进行,则正反应速率大于逆反应速率,答案选A。
<1,所以反应没有达到平衡状态,此时锌正反应方向进行,则正反应速率大于逆反应速率,答案选A。点评:该题是基础性试题的考查,主要是考查学生对平衡常数含义以及应用的了解掌握情况,意在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于激发学生的学习兴趣,提高学生的应试能力。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
 Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
 Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3
Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 (CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
(CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
 C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为
C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为 cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )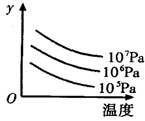
 2Z(g);
2Z(g); H<0,达到平衡时,下列说法正确的是
H<0,达到平衡时,下列说法正确的是 2SO3(g) △H<0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
2SO3(g) △H<0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是 2Q (g) + nR (g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值( )
2Q (g) + nR (g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值( )