题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为____________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=____。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
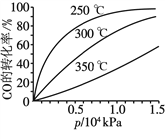
该反应的ΔH ____(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________。
(4)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
写出CH4 催化还原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的热化学方程式:______。
【答案】 NO2+H2O ═ 2HNO3+NO 8.96 -41.8 B 2.67 < 在250 ℃、1.3×104 kPa下,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加 CH4(g)+N2O4(g) ═ N2(g)+CO2(g)+2H2O(l) ΔH = -898.1 kJ·mol-1
【解析】本题主要考查化学平衡的移动。
(1)NO2可用水吸收,相应的化学方程式为NO2+H2O ═ 2HNO3+NO。NH3~3e-,当转移1.2 mol电子时,消耗NH30.4mol,在标准状况下是0.4mol×22.4L/mol=8.96L。
(2)①反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=0.5(-196.6+113.0)kJ·mol-1=-41.8kJ·mol-1。
SO3(g)+NO(g)的ΔH=0.5(-196.6+113.0)kJ·mol-1=-41.8kJ·mol-1。
②A.该反应气体物质的量无变化,反应过程中压强一直保持不变,故A不能说明反应达到平衡状态;B.混合气体颜色随着反应进行而发生变化,当混合气体颜色保持不变时,反应达到平衡状态,故B能说明反应达到平衡状态;C.SO3和NO的体积比等于它们的化学计量数之比,SO3和NO的体积比一直保持不变, 故C不能说明反应达到平衡状态;D.每消耗1molSO3的同时生成1molNO2,都是逆反应速率,故D不能说明反应达到平衡状态。故选B。
③NO2与SO2起始体积比1∶2,设NO2体积转化x,测得上述反应平衡时NO2与SO2的体积比为1∶6,则(1-x):(2-x)=1:6,x=0.8,平衡常数K=0.82/(0.2×1.2)=8/3=2.67。
(3)压强一定时,CO的转化率随着温度升高而减小,说明升温平衡左移,该反应的ΔH<0。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在250 ℃、1.3×104 kPa下,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加。
(4)将上述三个热化学方程式依次用a、b、c代替,a-b+2c得CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+N2O4(g) ═N2(g)+CO2(g)+2H2O(l) ΔH = -898.1 kJ·mol-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知1 g氢气完全燃烧生成液态水时放出热量143kJ, 18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
O=O | H-H | H-O(g) | |
1mol化学键断裂需要吸收的能量/kJ | 496 | 436 | x |
则表中x为
A. 188 B. 463 C. 557 D. 920
【题目】能源、环境与生产生活和社会发展密切相关。
一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)该反应的平衡常数表达式为K=____;若甲中反应10 s 时达到平衡,则0~10 s内甲中的平均反应速率v(H2)=______。
(3)下列情况能说明该反应一定达到平衡状态的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 气体的密度不再随时间改变
c. CO2和CH3OH的浓度之比不再随时间改变 d. 气体的平均相对分子质量不再随时间改变



