题目内容
7.硫、氯的单质和化合物应用广泛.(1)将硫铁矿和焦炭按物质的量比3:2混合放在炼硫炉中,通入适量空气中,发生下列燃烧反应:FeS2+C+O2→Fe3O4+CO+S.
请配平上述化学反应方程式:3FeS2+2C+3O2═Fe3O4+2CO+6S.
生成3mol硫,被氧化的物质的物质的量为2.5mol.
(2)盐酸是应用广泛的酸之一,它具有:a.酸性;b.氧化性;c.还原性;d.挥发性.请回答下列问题:
①浓盐酸长时间露置在空气中,溶液的质量减轻,盐酸表现了d(填序号).
②实验室用稀盐酸和锌粒反应制取氢气,盐酸表现了ab(填序号),反应的离子方程式为Zn+2H+═Zn2++H2↑.
③用盐酸除去铁表面的铁锈(Fe2O3),盐酸表现了a(填序号),反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O.
④实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O. 被还原的元素是Mn,还原剂是HCl,氧化产物是Cl2.
分析 (1)FeS2+C+O2→Fe3O4+CO+S中,Fe、C、S元素的化合价升高,O元素的化合价降低,结合电子、原子守恒分析;
(2)①浓盐酸易挥发;
②用稀盐酸和锌粒反应制取氢气,H元素的化合价由+1价降低为0,且生成盐;
③用盐酸除去铁表面的铁锈,反应生成氯化铁和水,氯化铁为盐;
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高.
解答 解:(1)FeS2+C+O2→Fe3O4+CO+S中,Fe、C、S元素的化合价升高,O元素的化合价降低,FeS2、C均为还原剂被氧化,结合电子、原子守恒可知反应为3FeS2+2C+3O2═Fe3O4+2CO+6S,由 反应可知,生成6molS时,5mol还原剂被氧化,则生成3mol硫,被氧化的物质的物质的量为2.5 mol,
故答案为:3FeS2+2C+3O2═Fe3O4+2CO+6S;2.5mol;
(2)①浓盐酸易挥发,则浓盐酸长时间露置在空气中,溶液的质量减轻,故答案为:d;
②用稀盐酸和锌粒反应制取氢气,H元素的化合价由+1价降低为0,且生成盐,则盐酸表现氧化性和酸性,离子反应为Zn+2H+═Zn2++H2↑,
故答案为:ab;Zn+2H+═Zn2++H2↑;
③用盐酸除去铁表面的铁锈,反应生成氯化铁和水,氯化铁为盐,则盐酸表现酸性,离子反应为,故答案为:a;Fe2O3+6H+═2Fe3++3H2O;
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,则Mn元素被还原,Cl元素的化合价升高,则HCl为还原剂,失去电子被氧化,对应氧化产物为Cl2,故答案为:Mn;HCl;Cl2.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


已知:R-CHO$\stackrel{O_{2},△}{→}$R-COOH
(1)A的分子式为C6H12O6C试剂是新制Cu(OH)2悬浊液.加B溶液的作用为中和H2SO4.
(2)反应⑥的反应类型为加成反应,E物质的官能团名称为羧基,F为高分子化合物,可以用来制造多种包装材料,其结构简式是
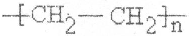 .
.(3)写出反应③和⑤的化学反应方程式
③
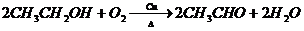
⑤C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
(4)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:CH2=CH2+Cl2+Ca(OH)2→
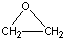 +CaCl2+H2O
+CaCl2+H2O工艺二:2CH2=CH2+O2$\stackrel{Ag}{→}$2
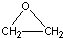
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,在实际生产中,应采
用工艺二(填“工艺一”或“工艺二”)更环保、更经济.
(5)实验室制备乙酸乙酯中使用了浓硫酸,为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图2所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
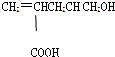
| A. | 1mol该有机物能与足量金属钠反应放出1molH2 | |
| B. | 能与乙醇发生酯化反应 | |
| C. | 1mol该有机物在催化剂作用下最多能与1molH2发生还原反应 | |
| D. | 1mol该有机物能与足量NaHCO3溶液反应放出2 molCO2 |
| A. | 1molO2与H2的混合气体中含有的分子数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,11.2L N2中含有的原子数目为NA | |
| D. | 标准状况下,22.4L H2O中含有的氧原子数为NA |
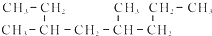 的命名正确的是( )
的命名正确的是( )| A. | 4-甲基-6-乙基庚烷 | B. | 3,5-二甲基辛烷 | ||
| C. | 2-甲基-1,4-二乙基戊烷 | D. | 3,6-二甲基辛烷 |
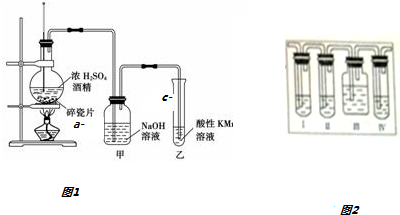 如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:
如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:
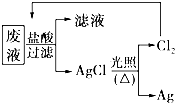 国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题: