题目内容
18.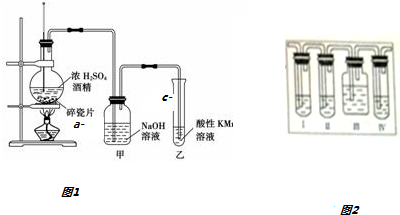 如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:
如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:(1)烧瓶内发生的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)如何检查装置气密性加热圆底烧瓶,导气管口有气泡逸出,停止加热,导气管末端有一小段水柱上升,说明装置气密性良好;
(3)能够说明乙烯具有还原性的现象是乙中酸性KMnO4溶液紫色褪去,装置B的作用是除去乙烯中混有的SO2、CO2等酸性气体;若无甲装置,是否能证明乙烯具有还原性,简述其理由:不能,SO2具有还原性,也可以使酸性KMnO4溶液褪色.
(4)有人设计了实验如图2确认上述混合气体中有乙烯和SO2.
各装置盛放的试剂是:ⅠA;ⅡB;ⅢA;ⅣD.
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液.
分析 (1)烧瓶中乙醇在浓硫酸作用下发生消去反应生成乙烯和水;
(2)利用压强差检查气密性;
(3)乙烯具有还原性,高锰酸钾具有氧化性,据此解答;碱能吸收酸性气体,据此解答即可;
(4)二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,据此进行解答.
解答 解:(1)烧瓶中乙醇发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)根据压强差检查气密性,其操作为:将加热圆底烧瓶,导气管口有气泡逸出,停止加热,导气管末端有一小段水柱上升,说明装置气密性良好,
故答案为:加热圆底烧瓶,导气管口有气泡逸出,停止加热,导气管末端有一小段水柱上升,说明装置气密性良好;
(3)乙中酸性KMnO4溶液紫色褪去,说明乙烯具有还原性,为了除去乙烯中混有的SO2、CO2等酸性气体,可以利用碱液吸收,若没有装置甲,则不能证明乙烯具有还原性,因为二氧化硫气体也可以使酸性KMnO4溶液褪色,
故答案为:乙中酸性KMnO4溶液紫色褪去;除去乙烯中混有的SO2、CO2等酸性气体;不能,SO2具有还原性,也可以使酸性KMnO4溶液褪色;
(4)装置Ⅰ用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置Ⅱ试管装有NaOH溶液除去SO2,装置Ⅲ通过品红溶液不褪色确认SO2已除干净,装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,所以试剂Ⅰ、Ⅱ、Ⅲ、Ⅳ分别为:A、B、A、D,
故答案为:A;B;A;D.
点评 本题考查物质性质实验方案的设计与评价,题目难度中等,明确乙烯的实验室制法及化学性质为解答关键,注意掌握检验混合气体中同时有乙烯和SO2的方法,为易错点.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案| A. | 李比希燃烧法 | B. | 铜丝燃烧法 | C. | 1H核磁共振法 | D. | 元素分析仪 |
甲:Al$\stackrel{H_{2}SO_{4}}{→}$Al2(SO4)2$\stackrel{NaOH}{→}$Al(OH)3
乙:Al$\stackrel{NaOH}{→}$NaAlO2$\stackrel{H_{2}SO_{4}}{→}$Al(OH)3
丙:
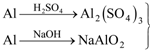 →Al(OH)3.
→Al(OH)3.| A. | 甲、乙消耗的原料同样多 | B. | 乙消耗的原料最少 | ||
| C. | 丙消耗的原料最少 | D. | 三者消耗的原料同样多 |
| A. | CH4分子的球棍模型: | B. | 乙醇的结构式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 溴乙烷的键线式: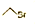 |
| A. | 2-乙基丁烷 | B. | 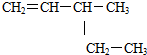 ;3-乙基-1-丁烯 ;3-乙基-1-丁烯 | ||
| C. | 2,6-二甲基-3-乙基庚烷 | D. | CH2=CH-CH=CH2;1,3,5-三己烯 |
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| B. | 2L0.5mol/L碳酸钠溶液中含有的CO32-数为NA | |
| C. | 标准状况下22.4LH2O的分子数为NA | |
| D. | 18gD2O和18gH2O中含有的电子数均为10NA |
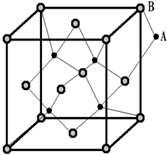 如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )| A. | AB | B. | A2B | C. | AB3 | D. | A2B3 |
| A. | 酸的水溶液呈酸性;则有酸性的水溶液也一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融HCl来制取氢气 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |