题目内容
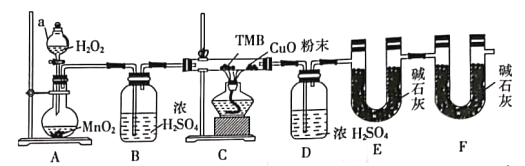
【题目】(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢气的热化学方程式分别为______________________________、__________________________________,制得等量H2所需能量较少的是系统______。(填Ⅰ或Ⅱ)
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
①H2S的平衡转化率α=_______%,反应平衡常数K=________。(用分数表示)
②在620 K重复上述试验,平衡后水的物质的量分数为0.05,H2S的转化率α2______α1,该反应的△H_____0。(填“>”“<”或“=”)
③向上述反应器中再分别充入下列气体,能使H2S转化率增大的是________。(填标号)
A. H2S B. CO2 C.COS D.N2
【答案】H2O(l)=H2(g)+1/2O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol II 5 1/76 > > B
【解析】
利用盖斯定律、“三段式”法计算解答。
(1)虚框内是水分解制氢(I),据盖斯定律将三个热化学方程式直接相加,得H2O(l)=H2(g)+![]() O2(g) ΔH=+286 kJ/mol。实框内是硫化氢分解制氢(II),三个热化学方程式直接相加,得H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol。制得等量H2时,系统(II)所需能量较少。
O2(g) ΔH=+286 kJ/mol。实框内是硫化氢分解制氢(II),三个热化学方程式直接相加,得H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol。制得等量H2时,系统(II)所需能量较少。
(2)610 K、2.5 L: CO2(g) + H2S(g) ![]() COS(g) + H2O(g)
COS(g) + H2O(g)
起始/mol: 0.10 0.40 0 0
转化/mol: x x x x
平衡/mol:0.10-x 0.40-x x x
据平衡时水的物质的量分数0.04,求得x=0.02。
①H2S的平衡转化率α1=![]() ×100%=5% ,反应的平衡常数K=
×100%=5% ,反应的平衡常数K=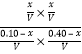 =
=![]() (用分数表示)。
(用分数表示)。
②相当于温度升高到620 K时,平衡移动后水的物质的量分数增大到0.05,即升温使平衡右移,故H2S的转化率α2 > α1,该反应的△H > 0。
③A. 再充H2S,平衡右移,但自身转化率减小;B. 再充CO2 ,平衡右移,H2S转化率增大;C.再充COS,平衡左移,H2S转化率减小;D.再充N2,平衡不移动,H2S转化率不变,能使H2S转化率增大的只有B。

 阅读快车系列答案
阅读快车系列答案