题目内容
9.A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的$\frac{3}{4}$倍,A、B、D、F这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:(1)写出B、E元素的名称B氮、E铝;
(2)写出C、D两种元素形成的原子个数比为1:1的物质与CO2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2;
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)②③;
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为H++HSO3-=SO2↑+H2O;
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为HS-+OH-=S2-+H2O.
分析 A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为氢元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为氮元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na;F元素的最外层电子数是其次外层电子数的$\frac{3}{4}$倍,F原子只能有3个电子层,最外层电子数为6,故F为硫元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为氧元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,应氢氧化铝、强碱、强酸反应,可推知E为Al,据此解答.
解答 解:A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为氢元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为氮元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na;F元素的最外层电子数是其次外层电子数的$\frac{3}{4}$倍,F原子只能有3个电子层,最外层电子数为6,故F为硫元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为氧元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,应氢氧化铝、强碱、强酸反应,可推知E为Al.
(1)由上述分析论证,B、E元素的名称分别为:氮、铝,故答案为:氮;铝;
(2)O、Na两种元素形成的原子个数比为1:1的物质为Na2O2,也二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)单质越容易与氢气反应,氢化物的还原性越强,元素的非金属性越强,单质的熔点属于物理性质,不能比较非金属性强弱,故②③正确、①错误,
故答案为:②③;
(4)H、O、Na、S四种元素可以形成两种酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4,二者相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,故答案为:H++HSO3-=SO2↑+H2O;
(5)H、O、S间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度中等,注意掌握元素化合物性质及常见10电子、18电子微粒.

(2)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂,高铁酸钾溶液长时间放置不稳定,会产生红褐色絮状物质及一种助燃性的气体,则该过程的离子方程式为4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)为测定三草酸合铁酸钾晶体中草酸根的含量,通常将其配成溶液再用H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4-同时被还原为Mn2+此反应不要(要/不要)外加指示剂,达到滴定终点的现象为当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点.
| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 在18gH218O中含有10NA个中子 | |
| C. | 在2L0.5mol/L的醋酸溶液中含有NA个CH3COO离子 | |
| D. | 常温下,16gCH4含有10NA个电子 |
①AlCl3溶液蒸干灼烧得到氧化铝 ②碳酸钠溶液中离子共有4种
③电镀时应把镀件置于电解槽的阴极 ④冶炼铝时,把氧化铝加热成为熔融体后电解
⑤钢铁表面常易腐蚀生成Fe2O3•nH2O ⑥催化剂降低了活化能,故可以改变化学反应限度.
| A. | ①③④⑤ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | ②④ |
| A. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| B. | 若X的最高正化合价为+5,则五种元素都是非金属元素 | |
| C. | 若R(OH)n 为强碱,则W(OH)n+1也为强碱 | |
| D. | 若HnXOm为强酸,则Y是活泼非金属元素 |
| A. | 氧化反应 | B. | 还原反应 | C. | 消去反应 | D. | 酯化反应 |
 根据如图回答问题.
根据如图回答问题.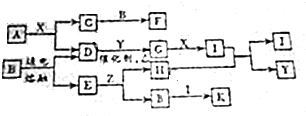
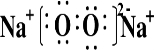 ;
;