题目内容
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 25℃时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001NA | |
| B. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| C. | 1L0.1mol•L-1的氨水中含有的NH3分子数小于0.1 NA | |
| D. | 在高温高压下,28gN2和6g H2充分反应生成NH3的分子数为2NA |
分析 A、根据溶液中亚硫酸氢根离子的电离过程为可逆反应进行分析;
B、求出OH-的浓度,然后根据n=CV来计算;
C、氨水中含有氨气分子、一水合氨分子、水分子;
D、氮气与氢气的反应为可逆反应,反应物不可能完全转化成生成物.
解答 解:A、亚硫酸氢钠溶液中亚硫酸氢根离子的电离为可逆反应,无法计算溶液中钠离子数目,故A错误;
B、溶液中的OH-的浓度C=0.01mol/L,故氢氧根的物质的量n=CV=0.01mol/L×1L=0.01mol,个数为0.01NA个,故B错误;
C、氨水溶液中溶质的物质的量为0.1mol,但氨水中含有氨气分子、一水合氨分子、水分子,则所含氨气分子总数远小于0.1NA,故C正确;
D、28g氮气的物质的量为1mol,6g氢气的物质的量为3mol,由于合成氨的反应为可逆反应,所以充分反应后生成氨气的物质的量小于2mol,生成NH3的分子数小于2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列混合物适用过滤法分离的是( )
| A. | KCl、NaNO3 | B. | 水、酒精 | C. | Na2CO3、CaCO3 | D. | MgSO4、ZnSO4 |
12.下列各组离子在常温下一定能大量共存的是( )
| A. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 在c(H+)/C(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
4.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为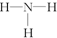 | ||
| C. | HCl的电子式为 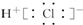 | D. | H2O中含有离子键 |
14.下列四个数据是不同条件下测出的合成氨的反应的速率,其中最慢的是( )
| A. | v(NH3)=0.15 mol/L•min | B. | v(H2)=0.1 mol/L•min | ||
| C. | v(N2)=0.1 mol/L•min | D. | v(N2)=0.002 mol/L•s |
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列说法正确的是( )
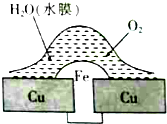

| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18gH2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2 NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与过量稀硫酸反应失去电子数为0.3 NA |
 (1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;
(1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;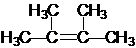 ;
;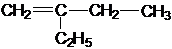 .
.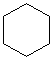 .
.