题目内容
8.某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+4种阳离子.甲、乙、丙3位同学设计的从该污水中回收金属铜的方案如下.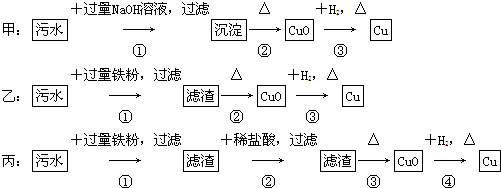
下列判断正确的是( )
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 乙方案中加过量铁粉可以将4种阳离子全部还原 | |
| C. | 甲方案中的反应涉及置换、分解、化合、复分解4种反应类型 | |
| D. | 丙方案会产生环境污染 |
分析 甲中生成沉淀含氢氧化铜、氢氧化铁,不利用制备纯Cu;乙中滤渣含Fe、Cu,不利于制备纯铜,丙中加铁粉后的滤渣含Fe、Cu,再加盐酸除去Fe,得到的滤渣只有Cu,以此来解答.
解答 解:解:甲中生成沉淀含氢氧化铜、氢氧化铁,不利用制备纯Cu;乙中滤渣含Fe、Cu,不利于制备纯铜,丙中加铁粉后的滤渣含Fe、Cu,再加盐酸除去Fe,得到的滤渣只有Cu,
A.由上述分析可知,只有丙可制备纯Cu,故A错误;
B.乙方案中加过量铁粉可以将Fe3+、Hg2+和Cu2+全部还原,故B错误;
C.甲方案中的反应涉及③为置换、②为分解、①为复分解三种反应类型,故C错误;
D.由上述分析可知,丙方案回收铜较好,但有盐酸废液,发生环境污染,故D正确.
故选D.
点评 本题考查物质的分离提纯方法及选择,为高频考点,把握物质的性质及制备流程中的反应为解答的关键,注意发生的反应的分析及物质的成分,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列说法正确的是( )
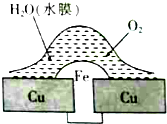

| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18gH2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2 NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与过量稀硫酸反应失去电子数为0.3 NA |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下不一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 工业上常用电解法电解熔融的DE3制备元素D的单质 |
3.已知含有电解质的凝胶具有导电性,铝镍胶体电池是一种正在开发的二次高能电池,放电时总反应为2Al+3Ni2O3+9H2O═2Al(OH)3+6Ni(OH)2.下列有关该电池的说法正确的是( )
| A. | 此电池的正极为Ni2O3,电池中的凝胶呈弱酸性 | |
| B. | 放电时,负极反应式为Al+3H2O-3e-═Al(OH)3+3H+ | |
| C. | 电池充电过程中,阳极附近溶液的pH升高 | |
| D. | 充电时,外接直流电源负极与铝镍胶体电池铝电极相连 |
13.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
17.用现有三组溶液:①汽油和氯化钠溶液 ②汽油和柴油的混合物 ③从氯化钠和单质碘的水溶液中分离出碘,分离以上物质正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
18.减少“酸雨”产生的措施:①少用煤作燃料;②把工厂烟囱升高;③在已酸化的土壤中加石灰;④燃料脱硫;⑤开发新能源.
其中有效措施是( )
其中有效措施是( )
| A. | ①②③ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |