题目内容
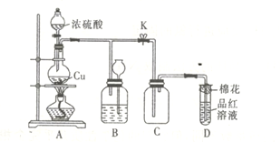
【题目】如图所示是工业生产硝酸铵的流程。
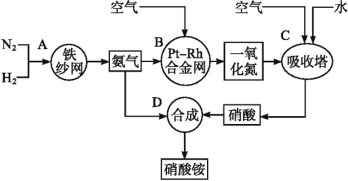
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:__。
(2)B装置中Pt-Rh合金网的作用是__,写出B中有关反应方程式:__。
(3)写出D中反应方程式:___。
(4)吸收塔C中通入空气的目的是___。A、B、C、D四个容器中的反应,属于氧化还原反应的是__(填字母)。
【答案】N+3H![]() 2NH3 催化作用 4NH3+5O2
2NH3 催化作用 4NH3+5O2 4NO+6H2O NH3+HNO3=NH4NO3 使NO全部转化成HNO3 A、B、C
4NO+6H2O NH3+HNO3=NH4NO3 使NO全部转化成HNO3 A、B、C
【解析】
氮气与氢气在铁作催化剂的条件下反应生成氨气,氨气与空气中的氧气反应生成NO,再与空气中的氧气、水反应生成硝酸,硝酸与氨反应生成硝酸铵。据此解答。
(1)N2和H2通过红热的铁纱网生成氨气,方程式为N+3H![]() 2NH3;
2NH3;
(2)氨气与氧气在催化剂的条件下生成NO,则合金网的作用为催化作用;方程式为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(3)氨与硝酸反应生成硝酸铵,方程式为NH3+HNO3=NH4NO3;
(4)NO与水不反应,通入空气后,氧气与NO和水反应生成硝酸,则空气可使NO全部转化成HNO3;根据分析可知,A、B、C、D四个容器中,A、B、C的反应为氧化还原反应,D中为非氧化还原反应。

【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)