��Ŀ����
����Ŀ��ijѧ����0.1000 molL��1KOHҺ�ζ�δ֪Ũ�ȵĴ��ᣬ������ֽ�Ϊ���¼����� A����ȡ20mL�������ע��ྻ����ƿ��������2��3��ָʾ��
B���ñ���Һ��ϴ�ζ���2��3��
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮������Һ
D��ȡ��KOH���ʽ�ζ�������0���̶�����1��2cm
E������Һ������0����0������ijһ�̶ȣ����¶���
F������ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȣ�
�ʹ�ʵ�������գ�
��1����ȷ���������˳���ǣ��������ĸ��д����
��2������B���������Ŀ������
��3������A�������֮ǰ�����ô���Һ��ϴ��ƿ��������յζ������Ӱ���� �� �����������С�������䡱��
��4��A�����У�ʹ�õ�ָʾ��Ϊ �� �жϵ���ζ��յ��ʵ�������ǣ���
��5����ͼ1Ϊijһ�μ�ʽ�ζ��ܵζ�ǰҺ�棬�����ֵΪmL��ͼ2Ϊ�ζ�����Һ�棬�εζ����̹�ʹ����mLKOH����Һ 
��6��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.1000molL��1��NaOH��Һ��20.00mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
��ô�����Һ��ȷŨ��Ϊ �� ������С�������λ��
���𰸡�
��1��B��D��C��E��A��F
��2����ֹ�ζ����ڱڵ�ˮ����Һϡ��
��3������
��4����̪��Һ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ
��5��0.70��20.00
��6��0.1000mol?L��1
���������⣺��1���к͵ζ����ռ�©��ϴ�ӡ���ϴ��װҺ��ȡ����Һ����ָʾ�����ζ���˳�����������ȷ��˳��Ϊ��B��D��C��E��A��F�� ���Դ��ǣ�B��D��C��E��A��F����2���ζ���������ˮϴ���ḽ������������ˮ����ʹ����Һ��Ũ�ȼ�С������Ҫ�ñ���Һ��ϴ�ζ���2��3�Σ�
���Դ��ǣ���ֹ�ζ����ڱڵ�ˮ����Һϡ�ͣ���3����ƿ������ˮϴ�Ӻ�������ô���Һ��ϴ����ʹ��ƿ�����ʵ����ʵ����������V������ƫ����c�����⣩= ![]() ������֪�������c�����⣩ƫ�����Դ��ǣ�ƫ��4���������������ط�Ӧ���ɵĴ�����Լ��ԣ��÷�̪��ָʾ���������յ�ʱ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ�����Դ��ǣ���̪��Һ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ����5���ζ��ܵĿ̶����϶��¿̶�������Ϊ0.01mL����ͼ��֪�ζ�ǰ����Ϊ0.70mL���յ����Ϊ20.70mL���εζ����̹�ʹ����20.00mLKOH��Һ�����Դ��ǣ�0.70��20.00����6��������ʵ�����ݲ��ϴ����������ı�NaOH��Һ�����ƽ��ֵΪ20.00mL��
������֪�������c�����⣩ƫ�����Դ��ǣ�ƫ��4���������������ط�Ӧ���ɵĴ�����Լ��ԣ��÷�̪��ָʾ���������յ�ʱ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ�����Դ��ǣ���̪��Һ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ����5���ζ��ܵĿ̶����϶��¿̶�������Ϊ0.01mL����ͼ��֪�ζ�ǰ����Ϊ0.70mL���յ����Ϊ20.70mL���εζ����̹�ʹ����20.00mLKOH��Һ�����Դ��ǣ�0.70��20.00����6��������ʵ�����ݲ��ϴ����������ı�NaOH��Һ�����ƽ��ֵΪ20.00mL��
CH3COOH�� | NaOH |
1 | 1 |
C��CH3COOH����20.00m | 0.1000molL��1��20.00mL�� |
C��CH3COOH��=0.1000molL��1��
���Դ��ǣ�0.1000molL��1 ��
�����㾫����ͨ�������������к͵ζ��������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㼴���Խ����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ͭ����������;�㷺�Ľ�������ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ����ս���ͭ����������ͼ�� 
��֪���������ʳ�����pH�����
Fe3+ | Cu2+ | Cr3+ | |
��ʼ����pH | 2.1 | 4.7 | 4.3 |
��ȫ����pH | 3.2 | 6.7 | a |
��ش��������⣺
��1����ҺI������������Ҫ�����ѧʽ����
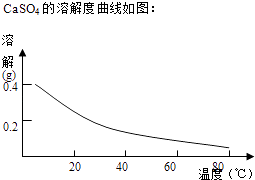
��2���ڢڲ������У��ȼ���Ca��OH��2������Һ��pH�����ڷ�ΧΪ �� Ȼ����Һ������80����ȹ��ˣ�����������ijɷ�Ϊ ��
��3��������Ũ�ȡ�1��10��5molL��1ʱ��������Ϊ���ӳ�����ȫ���ڢܲ������У���ҪʹCr3+��ȫ����������������Һ��a����СֵΪ �� ����֪��Kap[Cr��OH��3]=6.3��10��31 �� ![]() ��4.0��lg4=0.6��
��4.0��lg4=0.6��
��4��Cr��OH��3���ȷֽ�ΪCr2O3 �� �����ȷ�����ұ����������д�����ȷ������Ļ�ѧ����ʽ ��
