题目内容
【题目】氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , 已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3﹣在单位时间内的物质的量浓度的变化来表示该反应速率的速率﹣时间图象.下列说法不正确的是( ) 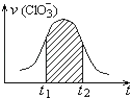
A.反应开始时速率增大可能是c(H+)增大引起的
B.纵坐标为v(H+)的速率﹣时间曲线与图中曲线不能完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”为t1至t2时间内的ClO3﹣的物质的量的减小值
【答案】D
【解析】解:A.由方程式:ClO3﹣+HSO3﹣﹣SO42﹣+Cl﹣+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.该方程式为ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , v(ClO3﹣):v(H+)=1:3,纵坐标为v(H+)的v﹣t曲线与图中曲线不重合,故B正确;
C.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C正确;
D.由ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , △n(Cl﹣):△n(ClO3﹣)=1:1,所以图中阴影部分“面积”可以表示t1﹣t2时间为n(Cl﹣)增加或者是ClO3﹣浓度的减小,故D错误;
故选D.

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .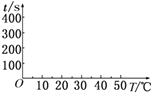
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .
