题目内容
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .
【答案】
(1)Zn+2H+═Zn2++H2↑;放热
(2)50;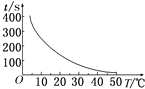
(3)温度每升高10℃,反应速率加快到原来的2倍
(4)>;G组中可形成Cu﹣Zn原电池,发生原电池反应,反应速率加快;>;F组中锌为粉末状,表面积较大,反应速率较快
【解析】解:(1.)Zn与盐酸反应生成氯化锌和氢气,离子反应为Zn+2H+═Zn2++H2↑,放出热量,为放热反应,所以答案是:Zn+2H+═Zn2++H2↑; 放热;
(2.)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半,则t1=100s× ![]() =50s,时间对温度的曲线图为
=50s,时间对温度的曲线图为  ,所以答案是:50;
,所以答案是:50;  ;
;
(3.)该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍所以答案是:温度每升高10℃,反应速率加快到原来的2倍;
(4.)G组中可形成Cu﹣Zn原电池,发生原电池反应,反应速率加快,则t1>t4;F组中锌为粉末状,表面积较大,反应速率较快,则t2>t3 , 所以答案是:>;G组中可形成Cu﹣Zn原电池,发生原电池反应,反应速率加快;>;F组中锌为粉末状,表面积较大,反应速率较快.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
物质性质 | 实际应用 | |
A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B | 元素硅处于金属与非金属分界线 | 单质硅常用作光导纤维 |
C | 常温下,钠钾合金熔点低且导热性好 | 原子反应堆导热剂 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
A. A B. B C. C D. D
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.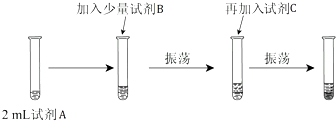
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .