题目内容
17.有一未知浓度的盐酸25mL,在加入5mol•L-1AgNO3溶液25mL后,改加NaOH溶液,结果用去1.0mol•L-1 NaOH溶液25mL恰好完全中和,则此盐酸的物质的量浓度为( )( )| A. | 0.5mol•L-1 | B. | 2.0mol•L-1 | C. | 1.5 mol•L-1 | D. | 1.0mol•L-1 |
分析 盐酸与硝酸银反应中,盐酸中的氢离子不参加反应,氯化氢在溶液中电离的氢离子与HCl的物质的量相等,根据NaOH+HCl=NaCl+H2O可知,氢氧化钠的物质的量就等于HCl的物质的量,据此计算出HCl的物质的量,再根据c=$\frac{n}{V}$计算出盐酸的物质的量浓度.
解答 解:盐酸中的氢离子不与硝酸银反应,即硝酸银不消耗氢离子,可以根据NaOH的物质的量计算出HCl的物质的量,25mL 1mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.025L=0.025mol,
根据反应方程式NaOH+HCl=NaCl+H2O可知,n(HCl)=n(NaOH)=0.025mol,
则此盐酸的物质的量浓度为:c(HCl)=$\frac{0.025mol}{0.025L}$=1mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确离子之间的反应实质为解答本题的关键,注意掌握有关物质的量的浓度的概念及计算方法.

练习册系列答案
相关题目
7.以下各种分子中,所有的原子都在同一平面上的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 四氯化碳 | D. | 甲苯 |
8.下列配合物的配位数不是6的是( )
| A. | Na3[AlF6] | B. | Na2[SiF6] | C. | [Cu(NH3)4](OH)2 | D. | [Pt(NH3)2Cl4]Cl4 |
2.下列各组物质仅用一种试剂不能鉴别的是( )
| A. | 四氯化碳、乙醇、苯、乙酸 | B. | 苯、甲苯、己烯、己烷 | ||
| C. | 苯、己烯、溴苯、氯化钠溶液 | D. | 乙酸、乙醇、硝基苯、乙酸乙酯 |
9.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(HF)}$ | C. | $\frac{c({F}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+}).c({F}^{-})}{c(HF)}$ |
6.将金属a放入b(NO3)2溶液发生如下反应:a+b2+═a2++b,则下列说法正确的是( )
| A. | 常温下,a或b可以与水发生反应 | |
| B. | a与b用导线连接插入H2SO4中,则形成原电池且b极上有H2放出 | |
| C. | a与b用导线连接插入b(NO3)2中一定构成原电池 | |
| D. | 用惰性电极电解a(NO3)2与b(NO3)2的混合液,在阳极先析出b |
17.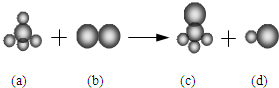 已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
 已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )| A. | 四种分子中的化学键均是极性键 | B. | a、c分子中中心原子均为sp3杂化 | ||
| C. | 四种分子中既有σ键,又有π键 | D. | b、d分子中共价键的键能b大于d |
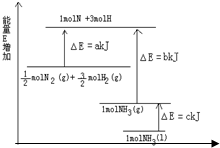 已知化学反应N2+3H22NH3的能量变化如图所示:
已知化学反应N2+3H22NH3的能量变化如图所示: