��Ŀ����
��Ӧ����v�ͷ�Ӧ��Ũ�ȵĹ�ϵ����ʵ�鷽���ⶨ�ģ���ѧ��ӦH2+Cl2=2HCl�ķ�Ӧ����v�ɱ�ʾΪv=K��c��H2����m��c��Cl2����n��ʽ��KΪ������m��n��ֵ�����±��е�����ȷ��,
|
c��H2����mol��L��1�� |
c��Cl2����mol��L��1�� |
v��mol��L��1��s��1�� |
|
1.0 |
1.0 |
1.0K |
|
2.0 |
1.0 |
2.0K |
|
2.0 |
4.0 |
4.0K |
�ɴ˿��Ƶ�m��n��ֵ��ȷ���ǣ� ��
A. m=1��n=1? B. m=1/2��n=1/2? C. m=1/2��n=1 D. m=1��n=1/2
D
���������ɵڶ������ݣ��ã�2.0K =K��2.0��m��1.0��n��m=1���ɵ��������ݣ��ã�4.0K =K��2.0��1��4.0��n��n=1/2����ѡD

.(13��)�ҹ��Ǹ��������,��������Ϊ�����һ,��¯��������Ϊ�ձ����������.
I.��֪��2CO(g)+ O2(g)��2CO2(g),��H��-566 kJ��mol-1
2Fe(s)+
 O2(g)��Fe2O3(s),��H��-825.5 kJ��mol-1
O2(g)��Fe2O3(s),��H��-825.5 kJ��mol-1
��Ӧ��Fe2O3(s)+
3CO(g) 2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
��.��Ӧ 1/3Fe2O3(s)+
CO(g) 2/3Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
2/3Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
(1)CO��ƽ��ת����=____________.
(2)�����CO��ƽ��ת����,�ٽ�Fe2O3��ת��,�ɲ�ȡ�Ĵ�ʩ��________.
a����߷�Ӧ�¶� b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ��� d����ʱ���ջ��Ƴ�����CO2
e�������ʯ,ʹ����ƽ���������ֽӴ�
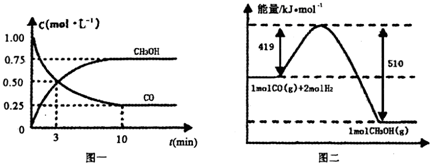
��.��¯���������ķ����е�CO�ɽ��л���,ʹ����һ�������º�H2��Ӧ�Ʊ��״�:
CO(g)+
2H2(g) CH3OH(g).�����ͼʾ�ش���������:
CH3OH(g).�����ͼʾ�ش���������:

(1)�ӷ�Ӧ��ʼ��ƽ��,��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)=________.
(2)�����¶Ⱥ�������ͬ�������ܱ�������,����ͬ��ʽͶ�뷴Ӧ��,��÷�Ӧ�ﵽƽ�ⅼ���й��������±�:
|
���� |
��Ӧ��Ͷ����� |
��Ӧ��� ת���� |
CH3OH��Ũ�� |
�����仯 (Q1��Q2��Q3������0) |
|
�� |
1mol CO��2mol H2 |
��1 |
c1 |
�ų�Q1 kJ���� |
|
�� |
1mol CH3OH |
��2 |
c2 |
����Q2 kJ���� |
|
�� |
2mol CO��4mol H2 |
��3 |
c3 |
�ų�Q3 kJ���� |
�����й�ϵ��ȷ����________.
A c1=c2 B.2Q1=Q3 C. 2��1=��2 D. ��1+��2=1
E. �÷�Ӧ������1mol CH3OH����ų�(Q1+Q2)kJ����
(3)����һ����ɱ���ܱ������г���l mol CO��2mol H2��1mol CH3OH,�ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6��,��÷�Ӧ��________(����������桱)��Ӧ�����ƶ�.
(4)�״�������������ȼ�ϵ��,�õ���ö�Ķ��Ե缫����Ũ����������Һ,д���õ�صĸ�����Ӧʽ___ ____��