题目内容
工业上用CO生产燃料甲醇。一定条件下发生反应:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)该反应的平衡常数表达式为:K=
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)= 。
(3)适宜的催化剂能 (选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率
d.提高反应物的转化率
(4)在2 L密闭容器中发生反应CO(g)+2H2(g) ![]() CH3OH(g)若T℃时,加入2mol CH3OH,反应达平衡后,生成CO 1 mol,此时向容器中同时加入2 mol的CH3OH和4mol的H2混合气体(保持温度不变),则平衡将 (填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数K的值为
CH3OH(g)若T℃时,加入2mol CH3OH,反应达平衡后,生成CO 1 mol,此时向容器中同时加入2 mol的CH3OH和4mol的H2混合气体(保持温度不变),则平衡将 (填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数K的值为
(5)恒容条件下,下列措施中能使n (CH3OH)/n(CO)增大的有 (选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2 d.再充入1mol CO
(6)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___________________
(1) K=C(CH3OH)/ C(CO) C2 (H2) (2分) (2) 0.075mol/L•min(2分)
(3) b、c(2分) (4)向正反应方向 (2分)K=1 (2分) (5)c(2分)
(6)CH![]() OH+8OH
OH+8OH![]() -6e
-6e![]() →CO
→CO![]() +6H
+6H![]() O(2分)
O(2分)
解析:略


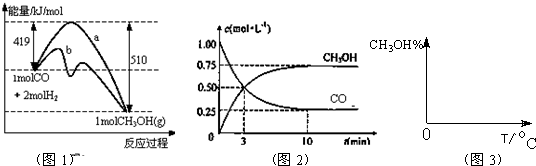

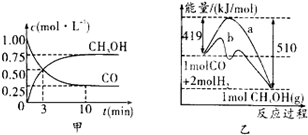
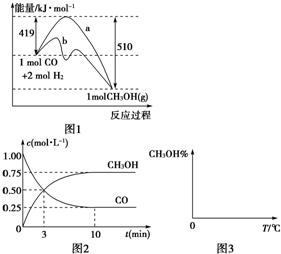 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.